Cómo el cuerpo produce un antibiótico endógeno con efectos antiinflamatorios
Investigadores dan ideas sobre la síntesis de ácido itacónico
Durante mucho tiempo, el ácido itacónico sólo se conocía como un producto metabólico de los hongos. Su función era desconocida, pero durante décadas se ha utilizado industrialmente para la producción de polímeros. En 2013, se descubrió sorprendentemente como un producto metabólico importante en el sistema inmunológico. Este papel recién descrito ha desencadenado una búsqueda de posibles aplicaciones clínicas. Investigadores del Centro Helmholtz para la Investigación de Infecciones (HZI) y del Centro TWINCORE para la Investigación Experimental y Clínica de Infecciones, fundado conjuntamente por el HZI y la Facultad de Medicina de Hannover, han resuelto la estructura cristalina de la enzima cis-aconitate decarboxilasa (CAD), una enzima sintetizadora de ácido itacónico. Sus hallazgos proporcionan la base para una mejor comprensión de la síntesis de ácido itacónico, el origen evolutivo de este importante paso metabólico y el papel del ácido itacónico en el sistema inmunológico. En particular, los investigadores identificaron variaciones naturales y posiblemente clínicamente importantes en la enzima CAD humana.
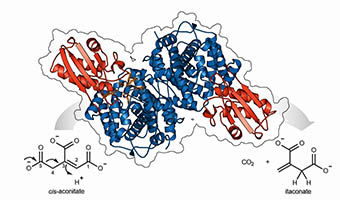
Estructura cristalina de la enzima cis-aconitate decarboxilasa, que sintetiza el ácido itacónico.
©HZI/Peer Lukat
Durante mucho tiempo, el ácido itacónico sólo se conocía como un producto metabólico de los hongos. Su función era desconocida, pero durante décadas se ha utilizado industrialmente para la producción de polímeros. En 2013, se descubrió sorprendentemente como un producto metabólico importante en el sistema inmunológico. Este papel recién descrito ha desencadenado una búsqueda de posibles aplicaciones clínicas. Investigadores del Centro Helmholtz para la Investigación de Infecciones (HZI) y TWINCORE, fundado conjuntamente por la HZI y la Facultad de Medicina de Hannover, han resuelto la estructura cristalina de la enzima itacónica cis-aconitate decarboxilasa (CAD). Sus hallazgos proporcionan la base para una mejor comprensión de la síntesis de ácido itacónico, el origen evolutivo de este importante paso metabólico y el papel del ácido itacónico en el sistema inmunológico. En particular, los investigadores iProduced por las células inmunes activadas, el ácido itacónico utiliza dos mecanismos diferentes para ayudar al sistema inmunológico a combatir a los invasores. Es un antibiótico endógeno que mata las bacterias absorbidas por ciertas células inmunitarias. También actúa como una molécula de señalización que adapta el metabolismo celular a la activación inmune, intentando suprimir las reacciones inflamatorias excesivas. "La estructura cristalina de la enzima CAD, que produce ácido itacónico, era desconocida hasta entonces. Podría proporcionarnos información sobre por qué la actividad de las enzimas varía de un organismo a otro", dice el Dr. Konrad Büssow, científico del Departamento "Estructura y Función de las Proteínas" de la HZI. Los investigadores han cerrado esta brecha de conocimiento y han resuelto la estructura cristalina de la EAC en ratones y humanos. "Aunque la enzima es una descarboxilasa, la estructura difiere mucho de otras descarboxilasas", dice el profesor Wulf Blankenfeldt, en cuyo departamento se llevaron a cabo los análisis de la estructura proteica. "Sólo hemos encontrado estructuras relacionadas en bacterias, pero generalmente carecen de CAD. Es probable que todas estas enzimas provengan de un antepasado común que evolucionó para sintetizar el ácido itacónico en organismos superiores".
Para aprender más sobre el papel del ácido itacónico en infecciones y procesos inflamatorios, los investigadores también estudiaron la ocurrencia de variantes de CAD en la población. "Tenemos la hipótesis de que las mutaciones que aumentan la actividad de la enzima proporcionan una mejor protección contra la infección por ciertas bacterias y reducen el riesgo de inflamaciones crónicas como la artritis reumatoide o la enfermedad inflamatoria intestinal", dice el Dr. Frank Pessler, jefe del grupo de investigación "Biomarkers for Infectious Diseases" de TWINCORE. "Curiosamente, una mutación particular de la EAC ocurre con relativa frecuencia en poblaciones de ascendencia africana. Esta enzima mutada es hiperactiva. La razón de ello podría ser la coevolución de las micobacterias, incluidas las bacterias causantes de la tuberculosis, con los primeros seres humanos en África. Por lo tanto, la mutación habría sido una ventaja selectiva para estas personas". Los investigadores encontraron que las mutaciones que llevan a la pérdida de la síntesis de ácido itacónico son extremadamente raras. Esto también sugiere que el ácido itacónico fue muy importante en la evolución humana, probablemente como protección contra ciertas infecciones y procesos inflamatorios, dice Pessler. Para los investigadores de HZI, la elucidación de la estructura cristalina CAD es un paso importante hacia la investigación futura de si las diferentes actividades enzimáticas también pueden ser un objetivo para terapias futuras. "Con estos hallazgos, además, será posible optimizar la enzima para aplicaciones técnicas y hacer más eficiente la síntesis de polímeros", dice Büssow.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Fangfang Chen, Peer Lukat, Azeem Ahmed Iqbal, Kyrill Saile, Volkhard Kaever, Joop van den Heuvel, Wulf Blankenfeldt, Konrad Büssow, Frank Pessler; "Crystal structure of cis-aconitate decarboxylase reveals the impact of naturally occurring human mutations on itaconitate synthesis"; Proceedings of the National Academy of Sciences, 2019.





















































