Como um mensageiro inflamatório desencadeia a doença de Alzheimer
A terapia combinada pode potencialmente abrandar a deterioração do cérebro
O sistema imunitário do cérebro contribui para o agravamento da doença de Alzheimer através do mensageiro inflamatório IL-12. No entanto, as células imunitárias do cérebro, as micróglias, são na realidade boas guardiãs. Elas eliminam os intrusos, como os micróbios, e limpam os resíduos celulares - incluindo as placas típicas que se desenvolvem na doença de Alzheimer. No entanto, no cérebro envelhecido, a microglia pode ser encontrada numa grande variedade de estados. Enquanto algumas continuam a funcionar bem, outras perdem gradualmente o seu efeito protetor e começam a produzir pequenas quantidades de mensageiros inflamatórios de forma permanente. Investigadores da Charité - Universitätsmedizin Berlin e do Centro Max Delbrück descrevem o mecanismo exato na revista Nature Aging.
Frank Heppner, Diretor do Instituto de Neuropatologia da Charité, e o Prof. Nikolaus Rajewsky, Diretor do Instituto de Berlim para a Biologia dos Sistemas Médicos do Centro Max Delbrück (MDC-BIMSB), juntamente com outros parceiros, conseguiram agora descobrir, através de análises meticulosas, como a substância mensageira inflamatória interleucina-12 (IL-12) alimenta o desenvolvimento e a progressão da demência. As suas descobertas poderão abrir caminho a uma terapia combinada e, eventualmente, abrandar a deterioração do cérebro.
"Durante décadas, a investigação sobre a doença de Alzheimer centrou-se quase exclusivamente nos depósitos caraterísticos de amiloide beta e tau. A inflamação era considerada um efeito secundário", afirma Frank Heppner. "O facto de os processos inflamatórios poderem estar no início da cadeia só gradualmente se está a tornar evidente". O seu laboratório já tinha publicado em 2012, na revista Nature Medicine, que o bloqueio das substâncias mensageiras IL-12 e IL-23 pode reduzir significativamente as alterações cerebrais típicas da doença de Alzheimer em ratinhos. "Mas não conseguimos desvendar o mecanismo - não conseguimos ir mais longe com as técnicas padrão", diz Frank Heppner. Frank Heppner esperava que a análise de uma única célula pudesse fornecer pistas decisivas e recorreu a Nikolaus Rajewsky.
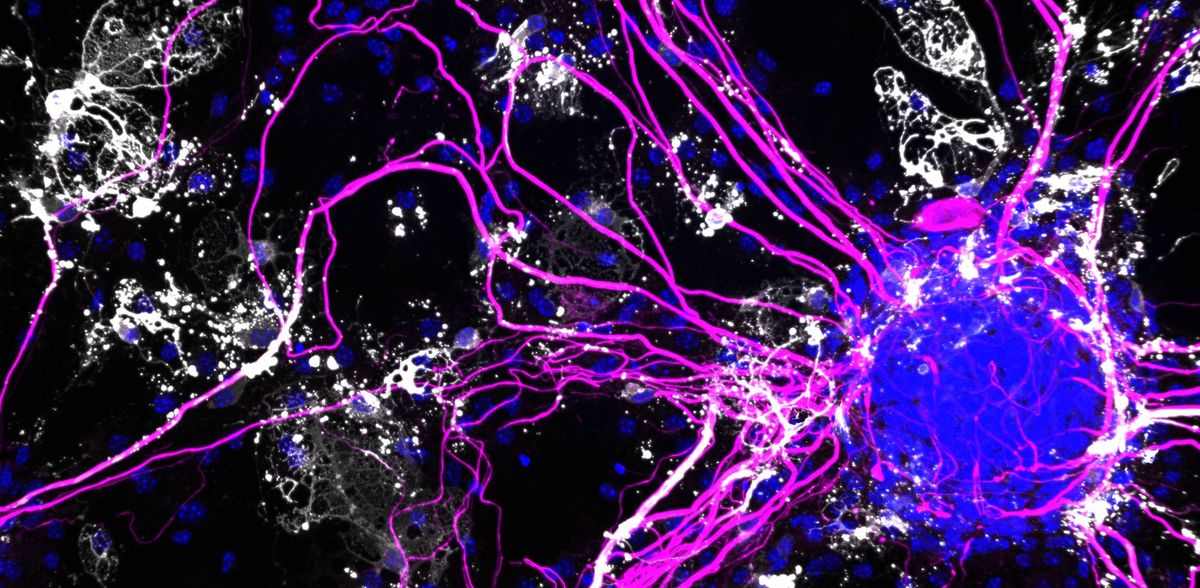
Células cerebrais presas e emaranhadas
Ao longo da sua vida, uma célula acede repetidamente às instruções contidas no seu material genético. Lê-as como um livro e aprende como deve reagir a influências externas. Os investigadores podem utilizar análises de uma única célula para observar este processo. Podem reconstruir quais os genes que foram lidos e traduzidos em proteínas para milhares de células em simultâneo. O resultado é uma enorme quantidade de dados que podem ser analisados com a ajuda da inteligência artificial e da aprendizagem automática. O senão: para a sequenciação de uma única célula, as células de uma amostra de tecido têm de ser separadas umas das outras de forma limpa, sem as danificar ou manipular involuntariamente. "Nos cérebros envelhecidos dos ratos - especialmente com placas de Alzheimer - as células estão tão coladas e emaranhadas que isso é praticamente impossível", diz Rajewsky.
A sua equipa passou vários anos a aperfeiçoar um protocolo que evita este obstáculo: em vez de células inteiras, os investigadores retiraram os núcleos das células do tecido cerebral e analisaram o ARN que aí se encontrava. Comparando estes resultados com dados publicados, como o Allen Brain Atlas, conseguiram determinar quando é que o protocolo fornecia uma imagem representativa de todas as populações de células. Por fim, sequenciaram o ARN de mais de 80.000 núcleos celulares e desenvolveram fluxos de trabalho específicos para analisar as montanhas de dados. Também reconstruíram a comunicação entre as células. "As duas equipas reuniram-se várias vezes para discutir o significado destes dados altamente complexos", diz Rajewsky. "Esta otimização meticulosa no início valeu a pena - de outra forma, as correlações não teriam sido mensuráveis."
Como é que a IL-12 danifica o cérebro de Alzheimer
O mensageiro inflamatório IL-12, que os médicos conheciam anteriormente sobretudo de doenças auto-imunes como a doença de Crohn ou a artrite reumatoide, desempenha um papel central no desenvolvimento da doença de Alzheimer. A doença danifica dois tipos de células importantes no cérebro: em primeiro lugar, os oligodendrócitos maduros, que normalmente produzem a camada isolante rica em gordura das fibras nervosas, a mielina. A camada isolante é crucial para a rápida transmissão de sinais no cérebro. Por outro lado, a substância mensageira liga-se a determinadas células nervosas, os interneurónios, e provoca a sua morte. Estas células nervosas especiais são particularmente importantes para a cognição e a memória. Inicia-se assim um círculo vicioso: quanto mais a micróglia produz IL-12, mais células são danificadas. E as micróglias ainda funcionais distraem-se com o facto de terem de eliminar resíduos celulares adicionais em vez de destruírem as placas de Alzheimer.
Os investigadores testaram o mecanismo em várias etapas em ratos e em tecido humano. Quando a equipa de Frank Heppner bloqueou a substância mensageira em culturas celulares e no modelo de ratinho, conseguiu travar as alterações relacionadas com a doença. Imagens de microscópio eletrónico obtidas no Instituto Max Planck de Ciências Naturais Multidisciplinares, em Göttingen, mostraram também como a estrutura da mielina e a densidade das fibras nervosas se alteravam quando a via de sinalização da IL-12 estava presente ou ausente nos ratinhos.
Análises de espetrometria de massa efectuadas na Universidade de Zurique confirmaram a alteração da composição da camada isolante rica em gordura. Quando a equipa de Frank Heppner analisou tecidos de autópsias de doentes de Alzheimer, a correlação foi novamente confirmada. Quanto mais avançada era a doença, mais IL-12 era encontrada. As culturas de células com oligodendrócitos humanos também reagiram de forma extremamente sensível à IL-12.
Abordagem para uma terapia combinada
"Dispomos agora de uma imagem muito pormenorizada do mecanismo e as tecnologias de célula única foram um catalisador essencial para isso. A única questão em aberto é saber que tipo de célula é afetado primeiro - os oligodendrócitos, os interneurónios ou ambos", diz Frank Heppner, que também é cientista no Centro Alemão de Doenças Neurodegenerativas (DZNE). Particularmente promissor: já existem no mercado substâncias activas que bloqueiam a IL-12. A equipa espera agora que colegas clínicos aceitem os dados e iniciem um ensaio clínico. "Se os princípios activos provarem o seu valor, será uma nova flecha na aljava. A doença de Alzheimer não tem apenas uma causa. Um dos eixos da doença é controlado pelo sistema imunitário, pelo menos em alguns doentes. Se quisermos abrandar a deterioração, precisamos de uma terapia combinada", diz Heppner. Esta pode começar cedo. Isto porque a IL-12 pode ser detectada como um biomarcador no sangue ou no líquido cefalorraquidiano.
Observação: Este artigo foi traduzido usando um sistema de computador sem intervenção humana. A LUMITOS oferece essas traduções automáticas para apresentar uma gama mais ampla de notícias atuais. Como este artigo foi traduzido com tradução automática, é possível que contenha erros de vocabulário, sintaxe ou gramática. O artigo original em Alemão pode ser encontrado aqui.
Publicação original
Shirin Schneeberger, Seung Joon Kim, Maria N. Geesdorf, Ekaterina Friebel, Pascale Eede, Marina Jendrach, Anastasiya Boltengagen, Caroline Braeuning, Torben Ruhwedel, ... Klaus-Armin Nave, Thorsten Hornemann, Burkhard Becher, Julia M. Edgar, Nikos Karaiskos, Christine Kocks, Nikolaus Rajewsky, Frank L. Heppner; "Interleukin-12 signaling drives Alzheimer’s disease pathology through disrupting neuronal and oligodendrocyte homeostasis"; Nature Aging, 2025-3-13