Afinar a tesoura genética
Novo mecanismo da proteína anti-CRISPR descoberto para o controlo orientado das tecnologias CRISPR
As tesouras de genes CRISPR-Cas oferecem uma vasta gama de aplicações potenciais - desde o tratamento de doenças genéticas a terapias antivirais e diagnósticos. Para garantir a segurança dessas aplicações, os cientistas estão a investigar especificamente bloqueadores que possam controlar ou impedir a atividade da tesoura genética. Um inibidor promissor é a proteína anti-CRISPR AcrVIB1, mas o seu mecanismo de ação era até agora desconhecido. Uma equipa de investigação do Instituto Helmholtz para a Investigação de Infecções baseadas em ARN (HIRI) em Würzburg, em colaboração com o Centro Helmholtz para a Investigação de Infecções (HZI) em Braunschweig, decifrou o modo de ação exato da AcrVIB1. Isto alarga as formas conhecidas pelas quais os Acrs podem desativar o CRISPR. Os resultados foram publicados na revista científica Molecular Cell.
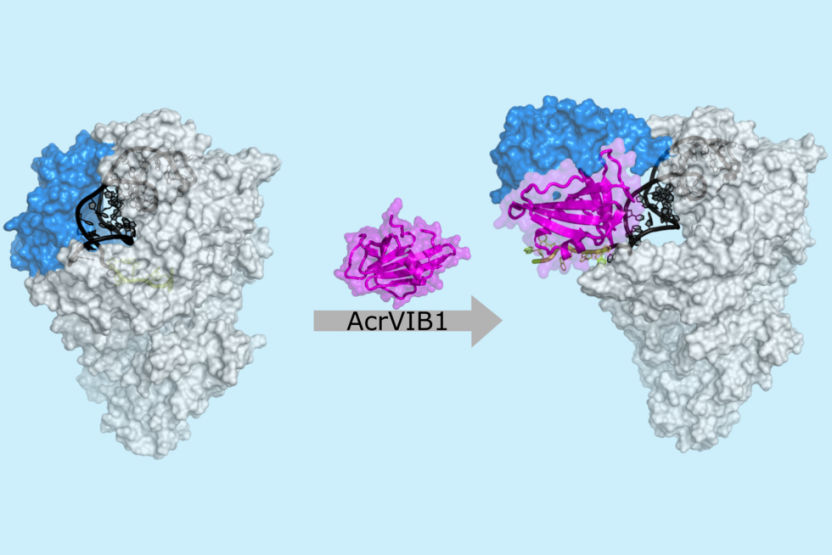
Micrografia de crioelectrões: A proteína anti-CRISPR AcrVIB1 (magenta) liga-se à nuclease Cas13b (cinzento claro), reforçando assim a sua ligação ao ARN CRISPR (crRNA; cinzento escuro e verde). A AcrVIB1 provoca um rearranjo estrutural na nuclease (azul) e, assim, liberta o ARN CRISPR, permitindo a sua clivagem e subsequente degradação.
© HZI / Stefan Schmelz
Sempre houve uma corrida ao armamento evolutiva entre as bactérias e os seus vírus, os chamados fagos. Para se protegerem dos ataques dos fagos, as bactérias desenvolveram mecanismos de defesa sofisticados que lhes permitem reconhecer os vírus invasores e torná-los inofensivos. Ao mesmo tempo, os fagos descobriram estratégias engenhosas para contornar estas defesas. Um excelente exemplo desta batalha constante são os sistemas de defesa CRISPR-Cas das bactérias e as proteínas anti-CRISPR (Acrs) dos fagos, que podem bloquear especificamente estas "tesouras de genes" bacterianas.
Para além da sua função de defesa, as proteínas anti-CRISPR permitem um controlo mais preciso das tecnologias CRISPR. No entanto, para que o seu potencial seja plenamente aproveitado, é importante compreender os seus mecanismos subjacentes. Investigadores do Instituto Helmholtz para a Investigação de Infecções Baseadas em RNA (HIRI), um local do Centro Helmholtz para a Investigação de Infecções (HZI) em Braunschweig, em cooperação com a Julius-Maximilians-Universität Würzburg (JMU), juntamente com cientistas do HZI, elucidaram ainda mais a função de uma proteína anti-CRISPR importante, mas anteriormente não caracterizada.
"Num estudo anterior, utilizámos um algoritmo de aprendizagem profunda para detetar novas Acrs. O resultado foi a descoberta da primeira proteína anti-CRISPR que tem como alvo a nuclease Cas13b: AcrVIB1", afirma o chefe do departamento de investigação do HIRI, Prof. Chase Beisel, que liderou o estudo juntamente com o departamento do Prof. Wulf Blankenfeldt no HZI. "A nuclease Cas13b pode reconhecer e cortar o ARN. Atualmente, é utilizada para desativar genes - seja para investigar a sua função, eliminar vírus ou combater doenças genéticas". A forma como a proteína AcrVIB1 inibe a Cas13b permanecia desconhecida - até agora. Num estudo publicado hoje na revista científica Molecular Cell, a equipa de investigação apresenta este mecanismo de bloqueio completamente novo.
Um beco sem saída de ARN
A nuclease Cas13b interage com um ácido ribonucleico CRISPR (crRNA), que serve de molécula guia para reconhecer sequências de ARN complementares - como as dos fagos. Assim que o ARN-alvo se liga, o Cas13b pode clivar não só estas moléculas de ARN complementares, mas também todos os outros ARNs na vizinhança, levando à sua degradação. Enquanto a maioria das proteínas anti-CRISPR conhecidas bloqueiam etapas individuais deste processo, como a ligação do crRNA ou o reconhecimento do alvo, a AcrVIB1 utiliza uma abordagem diferente: a proteína não impede a ligação entre o crRNA e a nuclease, mas reforça-a. No entanto, o par resultante é disfuncional, pelo que a enzima não pode começar a degradar os ARN-alvo, mesmo que estes estejam presentes. Além disso, o ARNm ligado torna-se suscetível de ser atacado por ribonucleases celulares, enzimas que degradam as moléculas de ARN.
"A ligação mais estreita entre a nuclease e o ARN-guia foi completamente inesperada. Um mecanismo mais simples e, portanto, inicialmente esperado, teria sido impedir o acoplamento do ARN-guia desde o início", diz a primeira autora, Katharina Wandera, que completou o seu doutoramento no laboratório de Chase Beisel, explicando os resultados. "No entanto, o caminho seguido pelo AcrVIB1 parece ser mais eficaz: A AcrVIB1 liga-se fortemente à Cas13b e inativa a nuclease. Ao mesmo tempo, acelera a degradação dos RNAs-guia, de modo que Cas13b se torna uma espécie de 'beco sem saída' para os crRNAs".
A equipa de Chase Beisel no HIRI e o laboratório de Wulf Blankenfeldt no HZI uniram forças para decifrar a estrutura do mecanismo inibitório com maior precisão. Usando imagens de alta resolução por microscopia crioelectrónica, o grupo de Blankenfeldt mostrou que o AcrVIB1 se liga ao Cas13b enquanto a região de ligação ao crRNA permanece livre. "A nossa descoberta fornece um modelo para o desenvolvimento de moléculas que possam imitar ou modificar a função da proteína anti-CRISPR", afirma Blankenfeldt. Estes são os primeiros dados publicados da nova instalação de microscopia crioelectrónica do HZI.
Um campo alargado
"No futuro, poderemos utilizar moléculas como a AcrVIB1 especificamente para regular ou desativar temporariamente os sistemas CRISPR em várias aplicações", afirma Blankenfeldt. Esta descoberta oferece, portanto, potencial para melhorar ainda mais a segurança e a precisão das tecnologias baseadas em CRISPR.
"A decifração deste mecanismo também oferece informações valiosas sobre a co-evolução de bactérias e vírus, que estão numa corrida constante para serem mais espertos do que os outros", explica Wandera. Este conhecimento poderá ajudar a compreender melhor os mecanismos de resistência bacteriana e, assim, impulsionar o desenvolvimento de novos antibióticos e aplicações em biologia sintética.
Em suma, este estudo não só contribui para uma melhor compreensão das estratégias anti-CRISPR, como também abre caminho a terapias e procedimentos de diagnóstico inovadores na medicina. "Mas isto é apenas o começo: há certamente muitos mais Acrs e novos mecanismos inibitórios à espera de serem descobertos", diz Beisel, dando uma perspetiva sobre futuros projectos de investigação.
Observação: Este artigo foi traduzido usando um sistema de computador sem intervenção humana. A LUMITOS oferece essas traduções automáticas para apresentar uma gama mais ampla de notícias atuais. Como este artigo foi traduzido com tradução automática, é possível que contenha erros de vocabulário, sintaxe ou gramática. O artigo original em Alemão pode ser encontrado aqui.






















































