Los investigadores pueden medir ópticamente las distancias en las moléculas
La microscopía MINFLUX permite determinar las distancias dentro de las biomoléculas mediante un microscopio óptico
Un equipo dirigido por los físicos Steffen Sahl y Stefan Hell, del Instituto Max Planck de Ciencias Multidisciplinares de Gotinga y del Instituto Max Planck de Investigación Médica de Heidelberg, ha logrado medir distancias dentro de biomoléculas utilizando un microscopio óptico, hasta un nanómetro y con una precisión de Ångström. La resolución intramolecular alcanzada con la microscopía MINFLUX permite registrar ópticamente las distancias espaciales entre subunidades en macromoléculas y, por tanto, detectar diferentes conformaciones de proteínas individuales en el microscopio óptico.

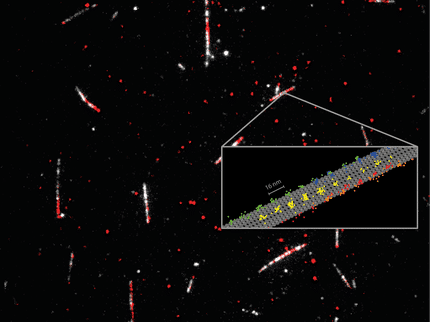
Poliprolinas de diferentes longitudes, polipéptidos relativamente rígidos, sirvieron como "reglas nanométricas" intramoleculares para demostrar las resoluciones MINFLUX más altas en el rango de distancias de transferencia de energía por resonancia de Förster (FRET). Las elipses de 2 sigmas muestran la incertidumbre de medida de las posiciones individuales.
© MPI f. Multidisziplinäre Naturwissenschaften/ Steffen J. Sahl

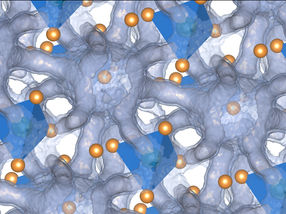
Dos subunidades idénticas del sensor de citrato bacteriano en disposición antiparalela (arriba) y paralela (abajo). Las medidas ópticas de posición en 3D con MINFLUX detectan los dos estados del dímero formado por las subunidades midiendo con gran precisión las distancias entre las moléculas fluorescentes de los extremos de la proteína. Las elipses muestran la incertidumbre de medida de las dos posiciones (1, 2 y 3 sigma).
© MPI f. Multidisziplinäre Naturwissenschaften/ Steffen J. Sahl


¿Qué aspecto tiene el nanocosmos de las células vivas? La microscopía de fluorescencia permite visualizar moléculas específicas en células o tejidos y se ha convertido en parte integrante de la investigación biológica y médica básica. Con la ayuda de nuevos conceptos de nanoscopía de fluorescencia de alta resolución, como la microscopía MINFLUX, es posible separar incluso biomoléculas muy próximas entre sí utilizando un microscopio óptico. Una cosa es obtener imágenes precisas del interior de las células, pero ¿puede utilizarse también la microscopía de fluorescencia para medir detalles dentro de proteínas individuales u otras macromoléculas?
Como han demostrado los investigadores Sahl y Hell, es posible. Y funciona extraordinariamente bien. En su último trabajo, el equipo demostró que el método MINFLUX también puede utilizarse para medir ópticamente la distancia tridimensional entre dos marcadores moleculares fluorescentes, cada uno unido a un lugar específico de una macromolécula, y ello con una precisión de Ångström.
Medir distancias de unos pocos nanómetros entre dos moléculas fluorescentes ancladas espacialmente era concebible con MINFLUX, pero no tan fácil de implementar o demostrar experimentalmente. "A distancias inferiores a 5 o 10 nanómetros, las moléculas fluorescentes, que tienen un tamaño aproximado de 1 nanómetro, suelen interactuar entre sí. Como resultado, no pueden emitir su luz fluorescente independientemente unas de otras, el requisito previo para una medición fiable de la distancia", explica Sahl, autor principal del estudio. "Como a muchos otros, me fascinó la alta resolución espacial y la precisión que es posible con el método MINFLUX propuesto y desarrollado por Stefan Hell", afirma el físico. "Al principio de nuestro trabajo había una estimación: así de pequeñas son las proteínas y así de precisos podemos llegar a ser en principio. ¿Por qué no alcanzamos resoluciones dentro de una biomolécula?". Porque hasta ahora, detectar distancias nanométricas entre dos proteínas, o sus subunidades, era prerrogativa de un método denominado transferencia de energía por resonancia de Förster, o FRET para abreviar, un método estándar en biología estructural y molecular.
Avanzando en el campo de la FRET
Sahl, Hell y sus colegas también han avanzado en este rango de resolución con la microscopía MINFLUX. Utilizaron moléculas fluorescentes fotoactivables especialmente desarrolladas en el Instituto Max Planck de Ciencias Multidisciplinares, que pueden "encenderse" una tras otra con una pequeña dosis de luz ultravioleta, pero que no interactúan entre sí. De este modo, las posiciones a medir en la macromolécula podían marcarse con una sola molécula fluorescente y registrarse independientemente con una precisión de Ångström.
"Hemos demostrado que con MINFLUX se pueden medir todas las distancias, hasta el contacto directo de las moléculas fluorescentes. Para ello, basta con determinar las posiciones de las moléculas en dos o tres dimensiones, es decir, 2D o 3D", explica Sahl. "Con nuestros experimentos, alcanzamos el rango de distancias de la FRET e incluso lo superamos".
La FRET, por su parte, estima la distancia entre dos moléculas de colorante de forma indirecta a través de la transferencia de energía de un colorante al otro. No sólo la distancia, sino también las orientaciones de las moléculas de colorante afectan al resultado de la medición. Esto puede dar lugar a incertidumbres a la hora de medir con precisión la distancia intramolecular. El método FRET también se ha visto a menudo limitado en estudios de subunidades proteicas cuando éstas se mueven fuera del rango de distancia medible. "Aquí es donde el método MINFLUX puede demostrar sus puntos fuertes al representar correctamente todas las distancias imaginables hasta 1 nanómetro sin ninguna laguna", afirma Hell. "MINFLUX es, por tanto, una herramienta nueva y muy potente en el repertorio de la biología estructural para investigar las proteínas y otras biomoléculas y sus interacciones".
De reglas moleculares y pequeñas moléculas de proteínas
Para demostrar la precisión y exactitud de la medición de distancias, el equipo de investigación utilizó una molécula con la que, en realidad, se inició el método FRET en un experimento clásico de los años sesenta. Por aquel entonces, Lubert Stryer y Richard Haugland consiguieron confirmar la dependencia de la distancia publicada por Theodor Förster en 1948. Para ello, utilizaron unas "reglas" moleculares de longitud media definida llamadas poliprolinas. Ahora, los investigadores del Max Planck han utilizado exactamente estas reglas en sus experimentos y han demostrado que, en principio, el método puede emplearse incluso en células.
En colaboración con el grupo de investigación de Stefan Jakobs, del Instituto Max Planck de Ciencias Multidisciplinares, se obtuvieron imágenes por separado de proteínas laminares marcadas con fluorescencia en células humanas, que forman filamentos de aproximadamente 3 nanómetros de grosor en la membrana que rodea el núcleo celular, utilizando el método MINFLUX. Además, los científicos demostraron el potencial de MINFLUX mediante experimentos con otras proteínas pequeñas, denominadas nanocuerpos, y sus oligómeros. Utilizando moléculas de anticuerpos como ejemplo, demostraron cómo las mediciones de posición múltiple permiten resolver la posición espacial de las subunidades proteicas entre sí.
Utilizando dos subunidades idénticas del sensor de citrato bacteriano, el equipo, en colaboración con el Departamento de Christian Griesinger del Instituto Max Planck de Ciencias Multidisciplinares, demostró que pueden medirse incluso distancias de 1 nanómetro. La microscopía MINFLUX también reveló claramente las dos disposiciones estructurales de las subunidades con una precisión del orden de 1 Ångström.
Hell, que recibió el Premio Nobel de Química en 2014 por el desarrollo de la microscopía de superresolución, se muestra satisfecho: "Desde que demostramos por primera vez el concepto MINFLUX en 2016, ha vuelto a ampliar radicalmente los límites de la microscopía óptica. Poder resolver dentro de macromoléculas no era realmente previsible en 2014".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.