Hacia una mejor comprensión de la defensa inmunitaria humana contra los virus ARN
Nuevos hallazgos en la lucha contra las pandemias
Anuncios
Un equipo internacional de investigación dirigido por el Prof. Dr. Janosch Hennig, de la Universidad de Bayreuth, ha descubierto cómo la proteína TRIM25 contribuye a la defensa contra los virus arn cuyo material genético está contenido en forma de ácido ribonucleico (ARN). Los resultados permiten comprender mejor los mecanismos moleculares del sistema inmunitario humano. Los investigadores han publicado sus hallazgos en Nature Communications.
El coronavirus ha demostrado que existe riesgo de pandemia si los virus peligrosos para el ser humano mutan: Estas mutaciones se propagan más rápidamente y son más difíciles de combatir por el sistema inmunitario humano. Por eso es tan importante comprender los mecanismos moleculares de las proteínas responsables de la respuesta inmunitaria innata en el ser humano. Los nuevos descubrimientos pueden servir para desarrollar nuevos fármacos antivirales para contener las pandemias.
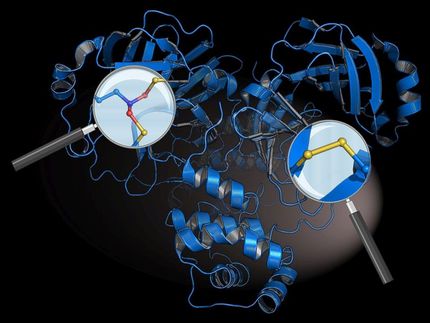
La proteína TRIM25 desempeña un papel central en la defensa inmunitaria innata contra los virus de ARN, pero su función sigue siendo poco conocida. Está claro que TRIM25, como la llamada ubiquitina E3 ligasa, desencadena la respuesta del sistema inmunitario al ARN vírico transfiriendo la molécula ubiquitina a la proteína RIG-I, que a su vez activa la defensa inmunitaria. También se descubrió hace algún tiempo que la propia TRIM25 puede unirse a varias formas de ARN. Sin embargo, hasta ahora no estaba claro cómo se une exactamente TRIM25 al ARN y cómo influye esta unión en la actividad antiviral.
Para comprender mejor el mecanismo molecular subyacente, un equipo internacional de investigación dirigido por el Prof. Dr. Janosch Hennig (Catedrático de Bioquímica IV) de la Universidad de Bayreuth ha investigado con más detalle la unión TRIM25-ARN. Entre otras cosas, en Bayreuth se llevó a cabo espectroscopia de resonancia magnética nuclear (RMN), que puede utilizarse para aclarar el entorno electrónico de los átomos y la interacción con los átomos vecinos. Utilizando éste y otros métodos biofísicos, los investigadores identificaron el mecanismo de unión al ARN de TRIM25. Además, se identificaron secuencias y estructuras en el ARN viral a las que TRIM25 se une específicamente.
A continuación, los científicos produjeron un mutante de TRIM25 que no puede unirse al ARN. Los investigadores utilizaron este mutante para comprobar la influencia de la unión al ARN en las propiedades antivirales de TRIM25: infectaron cultivos celulares sin TRIM25 con un virus y, a continuación, añadieron el TRIM25 normal o el mutante sin capacidad de unión al ARN. El examen de los cultivos mostró que la actividad del gen viral aumenta significativamente cuando TRIM25 no puede unirse al ARN. Esto indica un papel esencial de la unión al ARN de TRIM25 en la actividad antivírica.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Lucía Álvarez, Kevin Haubrich, Louisa Iselin, Laurent Gillioz, Vincenzo Ruscica, Karine Lapouge, Sandra Augsten, Ina Huppertz, Nila Roy Choudhury,... Gracjan Michlewski, Matthias W. Hentze, Frédéric H. T. Allain, Alfredo Castello, Janosch Hennig; "The molecular dissection of TRIM25’s RNA-binding mechanism provides key insights into its antiviral activity"; Nature Communications, Volume 15, 2024-10-1