Las células adiposas reprogramadas favorecen el crecimiento tumoral
Las mutaciones del supresor tumoral p53 no sólo tienen un efecto promotor del crecimiento en las propias células cancerosas, sino que también influyen en las células del microentorno del tumor. Científicos del Centro Alemán de Investigaciones Oncológicas (DKFZ) y del Instituto Weizmann de Israel han demostrado ahora que las células de cáncer de mama de ratón mutadas en p53 reprograman las células adiposas. Las células adiposas manipuladas crean un microentorno inflamatorio que dificulta la respuesta inmunitaria contra el tumor y favorece así el crecimiento del cáncer.
Ningún otro gen muta con tanta frecuencia en los tumores humanos como el gen del supresor tumoral p53. En alrededor del 30% de todos los casos de cáncer de mama, las células cancerosas presentan mutaciones o pérdidas en el gen p53. Estas mutaciones restringen la capacidad del p53 para actuar como "freno del cáncer" e impedir el desarrollo y la progresión del cáncer.
Los efectos de las mutaciones de p53 en las propias células cancerosas ya se han investigado intensamente. Sin embargo, la comprensión de que las mutaciones de p53 en las células cancerosas también pueden afectar a las células del microentorno del tumor -y, por tanto, impulsar adicionalmente el crecimiento del cáncer- sólo está creciendo lentamente.
Un equipo de investigadores dirigido por Almut Schulze, de la DKZF, y Moshe Oren, del Instituto Weizmann de Israel, investigó los efectos de las mutaciones de p53 en células de cáncer de mama sobre las células grasas, conocidas como adipocitos. Durante la progresión del cáncer de mama, los adipocitos, uno de los principales tipos celulares del tejido mamario, sufren una transformación. Los resultados de la investigación indican que esto aumenta la agresividad y la resistencia a la terapia de las células cancerosas de mama circundantes.
El equipo de Schulze y Oren lo ha demostrado ahora en adipocitos de tejido mamario de ratón: Las propiedades promotoras del cáncer de los adipocitos se potencian cuando las células del cáncer de mama portan mutaciones en p53.
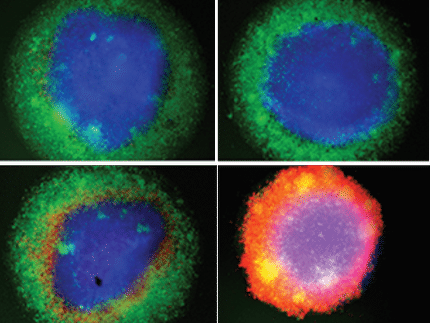
Los investigadores trataron adipocitos inmaduros con medio de cultivo en el que previamente habían crecido células de cáncer de mama con o sin mutaciones en p53. Este tratamiento desencadenó profundos cambios en el metabolismo y la actividad génica de los adipocitos y aumentó la producción de mensajeros proinflamatorios. Se impidió la maduración de los adipocitos, mientras que las células adiposas maduras volvieron a un estado inmaduro. Estos efectos sólo fueron leves tras el tratamiento con medios de cultivo celular procedentes de células de cáncer de mama con p53 funcional, pero fueron muy claros en el caso de medios procedentes de células cancerosas con p53 mutado.
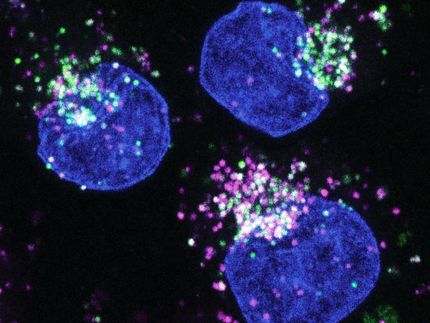
A continuación, los investigadores transfirieron células de cáncer de mama con p53 mutado o funcional junto con células adiposas pretratadas a ratones y compararon los tumores resultantes. Si p53 estaba mutado en las células cancerosas, aumentaba el número de células mieloides inmunosupresoras en el tumor. Las células inmunitarias migradas llevaban más PD-L1 en su superficie, que actúa como un potente freno a la defensa inmunitaria de los tumores.
Un resultado especialmente sorprendente fue que las células de cáncer de mama con determinadas mutaciones de p53 eran capaces de reprogramar las células precursoras adiposas vecinas -directa o indirectamente- para que fueran aún más proinflamatorias que las células de cáncer de mama que habían perdido por completo el supresor tumoral p53.
"Los defectos de p53 en las células del cáncer de mama parecen ser el motor central de la reprogramación promotora de tumores de las células adiposas", resume Almut Schulze, que dirigió el estudio junto con Moshe Oren. "Las células adiposas son un componente esencial del tejido mamario y, por tanto, pueden influir enormemente en la progresión tumoral. Por lo tanto, una comprensión detallada de la interacción entre las células cancerosas con mutación de p53 y los adipocitos podría proporcionar nuevas pistas sobre cómo se puede detener la progresión del cáncer de mama."
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.