Cicatrización de heridas sin cicatriz: lo que podemos aprender de los ratones espinosos
Un interruptor molecular dependiente de ERK antagoniza la fibrosis y favorece la regeneración
La respuesta a una lesión tras una herida profunda en la piel, un infarto de miocardio, un ictus, una lesión medular o una infección pulmonar suele producir tejido fibrótico, lo que provoca cicatrices permanentes y fallos en la función de los órganos. Se calcula que alrededor del 50% de las personas mueren por una enfermedad que implica cicatrización. En la actualidad, no existen tratamientos para restaurar la pérdida de función de un órgano debida a una lesión o una afección patológica. Por tanto, comprender los mecanismos moleculares que impulsan la fibrosis y la regeneración en mamíferos adultos es de vital importancia para desarrollar nuevas estrategias terapéuticas. En la última década, los ratones espinosos (especie Acomys) han surgido como un sólido sistema modelo para investigar la regeneración tisular en mamíferos adultos, ya que pueden regenerar estructuras tisulares complejas tras una lesión. Un equipo en torno a Kerstin Bartscherer, en colaboración con el laboratorio de Ashley Seifert, comparó las diferencias celulares y moleculares en la cicatrización de heridas entre ratones espinosos adultos y ratones de laboratorio (especie Mus). Identificaron la vía ERK como interruptor molecular entre la regeneración sin cicatriz y la cicatrización fibrótica. En conjunto, estos datos sugieren que una herida en mamíferos adultos puede estimularse para que se regenere sin cicatriz mediante el ajuste fino de ciertas vías de señalización centrales.

Imagen simbólica
Computer-generated image
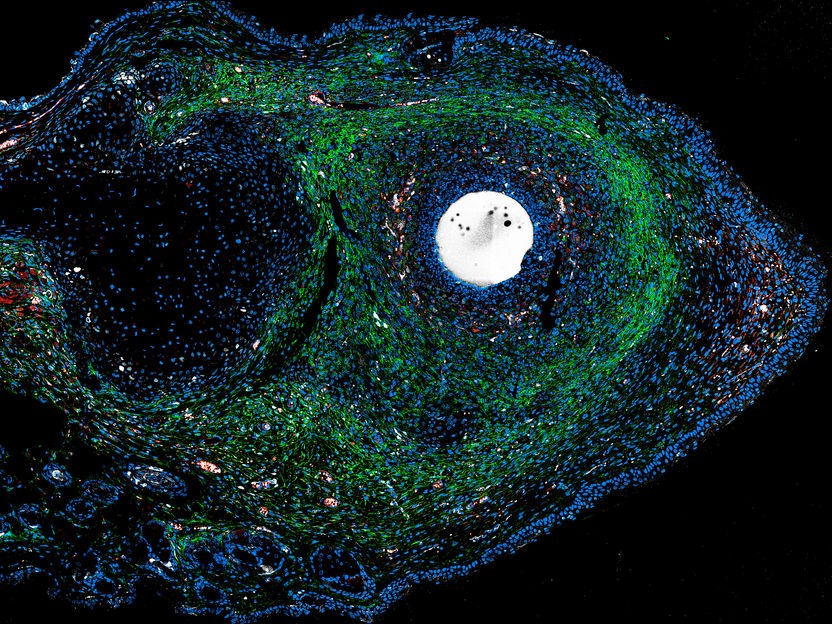
Los activadores ERK -administrados en una microesfera impregnada de factor de crecimiento- estimulan la regeneración tisular endógena en lesiones cicatriciales de mamíferos adultos.
Antonio Tomasso/Max Planck Institute for Molecular Biomedicine/Hubrecht Institute

A diferencia de los mamíferos y los humanos, algunas especies animales son auténticas maestras de la regeneración: una planaria puede cortarse en 200 trozos y cada uno de ellos volverá a crecer hasta convertirse en un organismo completo, las estrellas de mar y las salamandras pueden regenerar brazos completos y, en el pez cebra, pueden regenerarse grandes partes de la aleta o el corazón. Los estudios sobre estas especies ya han aportado importantes conocimientos sobre los mecanismos que subyacen al crecimiento y la diferenciación celular. Sin embargo, algunos interrogantes persisten o incluso surgen a raíz de estos hallazgos: ¿Por qué algunos animales se regeneran mejor que otros? ¿Cuáles son los actores moleculares clave de la regeneración tisular? Y: ¿los mamíferos que normalmente cicatrizan tras una lesión han perdido por completo su capacidad de regeneración o aún poseen rasgos regenerativos latentes?
En sus estudios anteriores, el equipo de Kerstin Bartscherer identificó la activación de la vía ERK como uno de los primeros procesos en la regeneración de las planarias. Ahora, los investigadores se propusieron averiguar si esta vía de señalización evolutivamente muy conservada también puede desencadenar la regeneración en mamíferos. Para ello, utilizaron el ratón espinoso (especie Acomys) como organismo modelo. Los ratones espinosos tienen una notable capacidad de regeneración, como descubrió en 2012 Ashley Seifert, de la Universidad de Kentucky (EE.UU.). Por ejemplo, cuando se les perfora la oreja, los ratones espinosos muestran una regeneración completa de los folículos pilosos, las glándulas sebáceas, la dermis y el cartílago, lo que les deja sin cicatrices. Las capacidades regenerativas de los ratones espinosos se extienden incluso a las lesiones de otros órganos.
"Ahora hemos demostrado que la actividad celular de ERK actúa como interruptor molecular entre la regeneración tisular y la cicatrización tisular en ratones adultos", afirma Antonio Tomasso. Tomasso es el primer autor del artículo publicado en Science Advances y fue estudiante de doctorado en el laboratorio de Kerstin Bartscherer, primero en el Instituto Max Planck de Biomedicina Molecular de Münster (Alemania) y luego en el Instituto Hubrecht de Utrecht (Países Bajos).
Los estudios comparativos con ratones espinosos y de laboratorio, sometidos al mismo tipo de lesión, permitieron a los científicos diseccionar la respuesta lesional en distintas fases. "En el laboratorio de Ashely Seifert, analicé la actividad de miles de genes a la vez para crear una imagen global de la función celular, tanto en experimentos de pérdida como de ganancia de función", afirma Antonio Tomasso.
Una vez identificados los receptores FGF y ErbB2 como de importancia clave para la vía ERK en ratones espinosos, Antonio Tomasso pudo inhibir selectivamente la actividad de la vía bloqueando estos receptores en Acomys: "La inhibición de ERK hizo que la respuesta de Acomys a las heridas pasara de la regeneración a la cicatrización, lo que se asemeja a la reparación fibrótica observada en los tejidos lesionados por el músculo", afirma.
Aún más intrigantes fueron los hallazgos tras la activación de la vía ERK en especies de Mus que normalmente no se regeneran: "Aquí observamos una respuesta regenerativa similar a la de los ratones espinosos", afirma Antonio Tomasso. "Incluso observamos la regeneración del folículo piloso, una característica que falta en la reparación del tejido cicatricial".
Los análisis de la actividad de ERK a nivel unicelular, en colaboración con Philip Lijnzaad, del Centro Princesa Máxima de Oncología Pediátrica de Utrecht (Países Bajos), revelaron que: "Durante la regeneración, ERK se activa en los queratinocitos, al ser el tipo celular dominante que constituye la epidermis y desempeña un papel esencial en la reparación de la piel, así como en las células del tejido conjuntivo", afirma Antonio Tamasso. "De hecho, estos datos sugieren que la actividad ERK tiene la capacidad de recablear las células del tejido conjuntivo hacia un programa regenerativo que de otro modo estaría latente".
"Curiosamente, observamos una elevada activación sostenida de ERK no sólo durante la regeneración del tejido auricular, sino también durante la recuperación de la piel y tras un infarto de miocardio en Acomys", afirma Kerstin Bartscherer. "Esto indica que una actividad ERK elevada y sostenida podría ser una característica general de los tejidos en regeneración".
"Para evaluar el papel funcional de la actividad ERK en otros paradigmas de lesión que forman una cicatriz, como el infarto de miocardio, la infección pulmonar o la lesión medular, necesitamos estudios adicionales", afirma Kerstin Bartscherer. "Sería interesante comprobar si, por ejemplo, pequeñas moléculas pueden activar con seguridad la actividad de ERK a nivel local cuando se administran en el órgano lesionado con el fin de promover la regeneración". Todo el trabajo experimental con animales se llevó a cabo en la Universidad de Kentucky o en el Instituto Hubrecht siguiendo estrictas directrices. El trabajo ha contado con una subvención del Consejo Europeo de Investigación (ERC-StG-IniReg) a Kerstin Bartscherer.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.