Tumores en retirada: La carencia de aminoácidos reduce los tumores infantiles
Las células cancerosas iniciaron su propia autodestrucción a través de la ferroptosis
Anuncios
Algunos tumores infantiles tienen una necesidad extrema de aminoácidos. Científicos del Centro Oncológico Infantil Hopp de Heidelberg (KiTZ), del Centro Alemán de Investigación del cáncer (DKFZ), de la Universidad de Heidelberg y de HI-STEM gGmbH han descubierto ahora los mecanismos moleculares que subyacen a este hecho y cómo podrían desactivarse las células cancerosas.
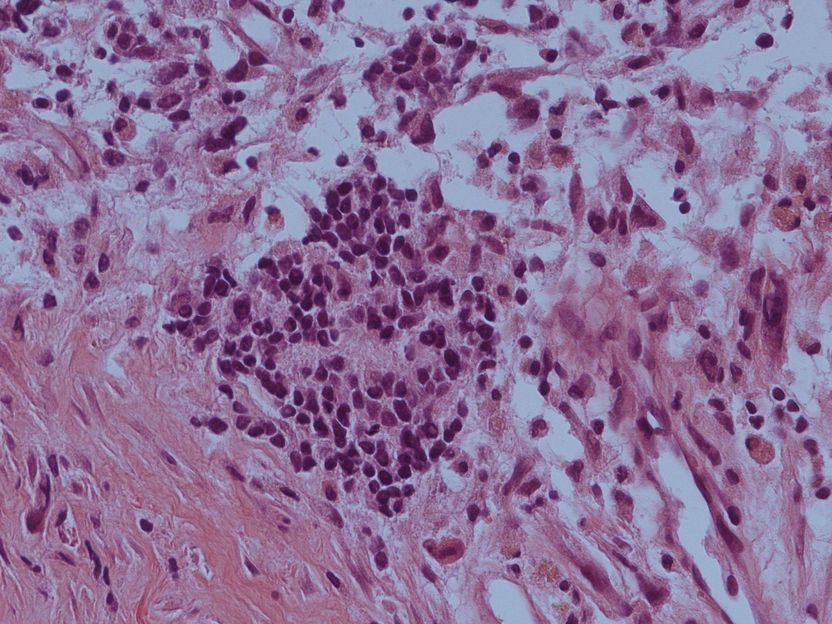
La sección histológica muestra una acumulación de células agresivas de neuroblastoma en el centro de la imagen.
© Westermann/DKFZ
Cada año, aproximadamente uno de cada 100.000 niños desarrolla un nuevo neuroblastoma, a menudo en el primer año de vida. Esto hace que los neuroblastomas sean un grupo de tumores relativamente común en los niños. Se forman en el tejido nervioso inmaduro durante el desarrollo embrionario y se producen principalmente en la glándula suprarrenal, la columna vertebral, el cuello, el pecho, el abdomen y la pelvis. Los neuroblastomas son difíciles de tratar y suelen ser resistentes a la terapia. Los bebés y los niños pequeños se ven especialmente afectados. En algunos casos, el tumor retrocede por completo sin ningún tipo de terapia. Sin embargo, en aproximadamente la mitad de los pacientes, progresa inexorablemente a pesar de una terapia muy intensiva.
Un importante regulador que determina la dirección en que se desarrolla la enfermedad es el gen cancerígeno MYCN. Sólo recientemente se ha sabido que este gen cancerígeno marca el rumbo para que las células precursoras se conviertan en células nerviosas maduras o en células de neuroblastoma malignas. Los neuroblastomas con una progresión desfavorable también llevan cientos de copias activas del gen MYCN en su genoma. La elevada actividad de MYCN provoca profundos cambios en el metabolismo de las células cancerosas, ya que MYCN activa y desactiva a su vez un gran número de otros genes. Pero, ¿qué ventaja le da esto a la célula cancerosa, y puede esta red altamente especializada ser interrumpida específicamente para luchar activamente contra las células cancerosas?
Estas fueron las preguntas que se planteó el equipo de científicos dirigido por Frank Westermann, del Centro Oncológico Infantil Hopp de Heidelberg (KiTZ) y del Centro Alemán de Investigación del Cáncer (DKFZ), Andreas Trumpp, del DKFZ y de HI-STEM* gGmbH, y Thomas Höfer, del DKFZ. En el presente estudio, los primeros autores, Hamed Alborzinia y Andrés Flórez, descubrieron que las células de neuroblastoma con alta actividad de MYCN necesitan una cosa en particular: el aminoácido cisteína. La cisteína es un componente importante de la mayoría de las proteínas y lípidos celulares. Las células cancerosas de crecimiento rápido necesitan grandes cantidades de estos componentes básicos para producir nuevas células.
Al mismo tiempo, las células cancerosas necesitan cisteína para protegerse de los peróxidos tóxicos naturales que se producen de forma condicionada por su metabolismo altamente activo. "El hambre de cisteína de las células de neuroblastoma es tan grande que utilizan dos vías para obtenerla", dice Sina Kreth, otra primera autora del estudio. "Utilizan la importación del aminoácido y, además, ponen en marcha una vía sintética alternativa para obtener cisteína a partir del aminoácido metionina", añade la primera autora, Lena Brückner.
Sin embargo, son precisamente estos procesos de adaptación los que hacen que las células de neuroblastoma sean sensibles. Si los científicos las privaban de cisteína, las células tumorales impulsadas por MYCN ya no podían inactivar los peróxidos tóxicos producidos y morían por ferroptosis, una forma especial de muerte celular. A continuación, el equipo de investigación comprobó si este proceso podía ser un potencial talón de Aquiles para una terapia contra el neuroblastoma maligno en ratones.
Los científicos cerraron deliberadamente el grifo de los tumores: Bloquearon la captación de cisteína, la síntesis de cisteína y también desactivaron una enzima clave que normalmente evita que las células cancerosas se envenenen con peróxidos. Las células cancerosas iniciaron entonces su propia autodestrucción mediante ferroptosis, y los tumores se redujeron.
"La muerte celular por ferroptosis se descubrió hace sólo unos años, y los resultados muestran ahora por primera vez, no sólo en cultivos celulares sino también en ratones con cáncer, cómo se puede manipular este proceso para matar células de neuroblastoma humano altamente agresivas induciendo la ferroptosis", subraya Hamed Alborzinia.
Los hallazgos también proporcionan una posible explicación de por qué algunos neuroblastomas con actividad moderada de MYCN en bebés y niños pequeños simplemente desaparecen en algunos casos: "Las células absorben básicamente menos cisteína en los primeros años de vida. Por lo tanto, cuando empiezan a dividirse de forma descontrolada, pronto se quedan sin reservas de cisteína y se inicia la muerte celular ferroptósica", explica Andrés Flórez. Algunos neuroblastomas sin actividad de MYCN no pueden escapar a esta autodestrucción y, entonces, simplemente mueren al cabo de cierto tiempo, cuando la cisteína empieza a escasear.
En el caso de los pacientes de alto riesgo con una elevada actividad de MYCN, el estudio proporciona los primeros datos sobre cómo el equilibrio entre la captación, la producción y el consumo de cisteína podría verse alterado de tal manera que estas células también inicien su autodestrucción. Ahora habrá que comprobar en ensayos clínicos si el principio recién descubierto también resulta eficaz en la terapia de los pacientes con neuroblastoma.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.