La glicación en el organismo: Desencadenante de la disfunción de las proteínas en el envejecimiento y las enfermedades relacionadas con la edad
El estudio demuestra poderosamente cómo se pueden estudiar las consecuencias de la glicación en todo el proteoma
Para mantener las funciones de los órganos, las proteínas de las células deben mantenerse en equilibrio (proteostasis). Este estado se altera con la edad. Una posible causa es la glicación, en la que los azúcares y las proteínas se combinan de forma irreversible. Estos productos finales de glicación avanzada (AGE) se acumulan y pueden provocar inflamación y daños. Un equipo de investigadores del Instituto Leibniz sobre el Envejecimiento - Instituto Fritz Lipmann (FLI) y del Hospital Universitario de Jena (UKJ) ha investigado ahora dónde se forman los AGE en la célula, qué influencia tienen en las proteínas y si contribuyen al envejecimiento y a las enfermedades metabólicas relacionadas con la edad.
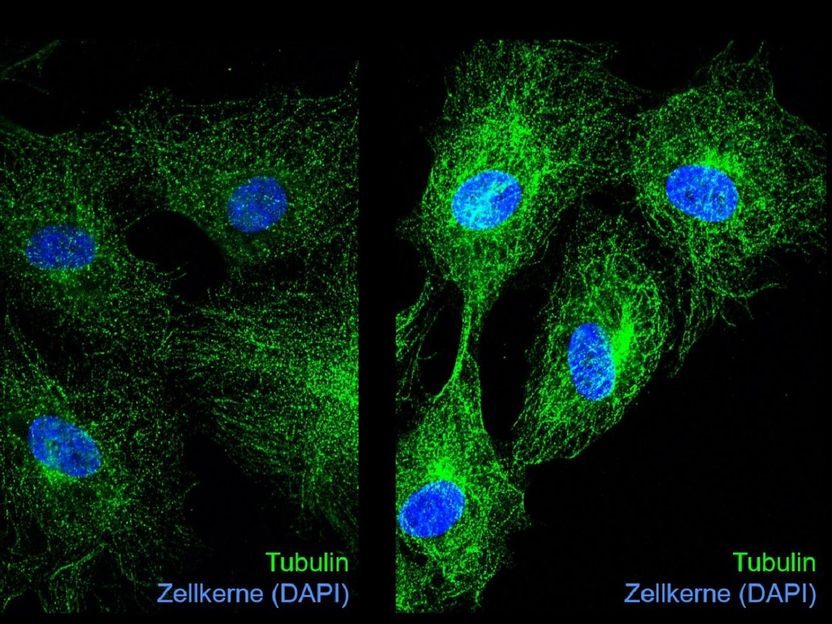
Microscopía de inmunofluorescencia de tubulina (verde) y núcleos celulares (azul) en células endoteliales no tratadas (izquierda) y tratadas con glioxal (derecha). La glicación de la tubulina por el glioxal da lugar a una alteración de la dinámica de los microtúbulos, lo que provoca un deterioro de la división celular.
Institute of Molecular Cell Biology/ UKJ / Katrin Spengler
Descrita en 1912 por el bioquímico francés Louis Maillard, la reacción química en la que los azúcares se combinan con las proteínas da lugar a la formación de moléculas que ya no son degradables (productos finales de glicación avanzada, AGE). Este proceso, conocido como "reacción de Maillard", parece desempeñar un papel importante en el proceso de envejecimiento y se considera que contribuye a numerosas enfermedades crónicas. Por ejemplo, los AGE se consideran factores de riesgo de enfermedades vasculares en la diabetes mellitus y favorecen la rigidez de los vasos sanguíneos. La glicación afecta a varias proteínas del organismo y puede perjudicar la funcionalidad y la estructura de las células y los tejidos afectados. Por ello, el proceso de glicación se considera cada vez más un posible motor de las enfermedades metabólicas y del proceso de envejecimiento.
Pero, ¿dónde tiene lugar exactamente la glicación en la célula, qué efectos tiene en proteínas específicas y cómo afecta la glicación a la función de toda la célula? Un equipo de investigadores del Instituto Leibniz sobre el Envejecimiento - Instituto Fritz Lipmann (FLI) de Jena y del Hospital Universitario de Jena (UKJ) ha llegado al fondo de estas y otras preguntas. El estudio, publicado en la revista "Nature Communications", investiga los efectos fisiopatológicos de los AGE en las proteínas intracelulares y su posible contribución al desarrollo de enfermedades metabólicas y al envejecimiento.
Glicación de las proteínas
"La glicación no enzimática de las proteínas por la reacción con azúcares o dicarbonilos altamente reactivos como el glioxal aumenta cuando los niveles de glucosa en el organismo son persistentemente altos", afirma el Dr. Alessandro Ori, jefe del grupo de investigación del FLI. Uno de los AGE más comunes es la N(6)-carboximetilisina (CML), cuya formación se desencadena en parte por la reacción con el glioxal. "La CML es químicamente estable y se acumula en los tejidos humanos principalmente en enfermedades como la diabetes mellitus y la aterosclerosis, pero también en el envejecimiento normal. Por tanto, la CML puede entenderse como un biomarcador del envejecimiento", añade la profesora Regine Heller, del UKJ. Mientras que la glicación de proteínas extracelulares como la hemoglobina o el colágeno está bien descrita, se sabe poco sobre esta modificación en las proteínas intracelulares.
Enfoque integral para caracterizar las proteínas modificadas por la LMC
Para poder captar los cambios en las proteínas causados por la glicación en todo el proteoma, los investigadores utilizaron dos modelos. "Por un lado, utilizamos cultivos celulares clásicos, como fibroblastos y células endoteliales, para determinar la influencia de la glicación en las proteínas. Por otro lado, también utilizamos células de órganos de ratones jóvenes y viejos para deducir la influencia holística de la glicación en la función y el modo de acción de las proteínas", explica el Dr. Ori el procedimiento del estudio del proteoma.
Un novedoso flujo de trabajo basado en el enriquecimiento selectivo de péptidos modificados por la LMC, combinado con la espectrometría de masas, permitió la caracterización y cuantificación exhaustiva de las proteínas objetivo y sus vías metabólicas. Se revelaron por primera vez cientos de sitios de glicación específicos en ambos modelos.
La glicación en función del recambio y la abundancia de las proteínas
Independientemente de su localización en determinados compartimentos de la célula, las proteínas que se metabolizaban más lentamente tenían más probabilidades de sufrir glicación que las proteínas con un recambio más rápido. "Las proteínas de más lento recambio se modificaron con más frecuencia", dijo el Dr. Ori, explicando el resultado en ambos modelos. Esto concuerda con estudios anteriores que han demostrado que los AGE se acumulan principalmente en los tejidos con un lento recambio de proteínas, como el cartílago y la piel.
"Aunque los sitios glicados eran detectables en las proteínas estudiadas en todo el rango dinámico en ambos sistemas modelo, la glicación se correlacionaba fuertemente con la abundancia de proteínas. Es decir, si las proteínas eran muy abundantes, también estaban modificadas con mayor frecuencia", resumió el Dr. Ori. "A partir de estos resultados, deducimos que tanto el recambio lento como la abundancia de proteínas son factores clave importantes para la glicación de proteínas en las células". Estos resultados proteómicos se obtuvieron como parte de la tesis doctoral de Simone Di Sanzo en el FLI dentro del Grupo de Formación en Investigación 2155 de la DFG "Modificación de proteínas: Un mecanismo clave para el envejecimiento (ProMoAge)".
Glicación de proteínas específica para cada órgano
"Para estudiar el impacto del envejecimiento en la glicación, se cuantificaron los sitios de glicación en el corazón, el riñón y el hígado de ratones jóvenes y viejos, y se analizaron en paralelo con los cambios en el proteoma completo de los mismos órganos", explica el Dr. Ori. Esta combinación de datos permitió identificar sitios específicos en las muestras de órganos; la glicación parece ser específica de cada órgano.
"Sin embargo, también se identificaron proteínas modificadas, como las histonas, en todos los órganos de los ratones viejos estudiados", añade el profesor Heller. "Nuestros datos sugieren que, por un lado, la glicación es en gran medida específica de un órgano y, por otro, la extensión de la modificación aumenta con el envejecimiento de forma específica para cada lugar, lo que probablemente se deba a la menor cantidad y actividad de las enzimas para la desintoxicación de los compuestos dicarbonílicos altamente reactivos en los órganos viejos."
La glicación inhibe la división celular
"En las células endoteliales, nuestro tratamiento con glioxal provocó la detención del ciclo celular, es decir, la división celular se vio inhibida masivamente por la acumulación de LMC", explica la Dra. Katrin Spengler, del UKJ, que codirigió el estudio. Esto se debió en parte a la alteración de la expresión de los reguladores del ciclo celular. Para comprender mejor cómo la glicación de las proteínas afecta a la progresión del ciclo celular, los investigadores se centraron en las tubulinas, que tienen, entre otras tareas, una importante función en la regulación del ciclo celular. Para cumplir sus funciones, las tubulinas forman filamentos, los llamados microtúbulos, que deben someterse a continuos procesos de ensamblaje/desensamblaje.
"Realizando experimentos con tubulina purificada glicada y observando los microtúbulos en las células endoteliales tratadas con glioxal mediante inmunofluorescencia, descubrimos cambios en la dinámica de los microtúbulos, lo que podría explicar, en parte, la inhibición de la división celular", continúa el Dr. Spengler. La glicación de las tubulinas puede interferir con otras modificaciones importantes de las tubulinas, como la acetilación, cambiando así el "código de la tubulina", que determina la función de los microtúbulos.
Comprender el papel de la glicación y su impacto en el envejecimiento de las células
Este estudio demuestra de forma contundente cómo se pueden estudiar las consecuencias de la glicación en el conjunto del proteoma combinando los análisis de espectrometría de masas con los estudios mecanísticos en sistemas celulares. El análisis permite mapear los sitios de glicación y muestra cómo las distintas glicaciones se asocian con funciones celulares específicas. Esto contribuye significativamente a una mejor comprensión de cómo la glicación de las proteínas puede afectar al envejecimiento y a las enfermedades metabólicas relacionadas con la edad.
"Cuando se expone a concentraciones fisiopatológicas de azúcares y compuestos dicarbonílicos altamente reactivos durante un periodo prolongado de tiempo, como ocurre en las personas mayores o en los diabéticos, la glicación de la tubulina y otras proteínas puede ser un acontecimiento inicial que conduzca progresivamente al deterioro de la función celular y, en última instancia, a la disfunción de los órganos", resumen los investigadores. Por tanto, la identificación de los lugares específicos de glicación y/o el grado de glicación podría ayudar a identificar el riesgo de padecer enfermedades posteriores relacionadas con la edad.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.






















































