Ordenado desde lejos: Cómo las toxinas de los gérmenes se vuelven peligrosas
Los investigadores destacan el mecanismo que potencia la toxicidad de los patógenos en la célula humana
Anuncios
La bacteria P. aeruginosa causa la infección secundaria más común en pacientes hospitalizados con gripe, COVID-19 o fibrosis quística y es resistente a los antibióticos. Otro patógeno bacteriano, el Vibrio vulnificus, se encuentra en el marisco crudo y en las aguas salobres y puede tener consecuencias raras, pero mortales, para los seres humanos. Para envenenar las células, ambos patógenos utilizan unas toxinas llamadas ExoY que son casi inactivas dentro de la bacteria. Sin embargo, una vez inyectada en las células, ExoY da un giro al volverse diez mil veces más activa. Sin embargo, hasta hace poco se desconocía el mecanismo exacto que conduce a esta actividad diez mil veces mayor.
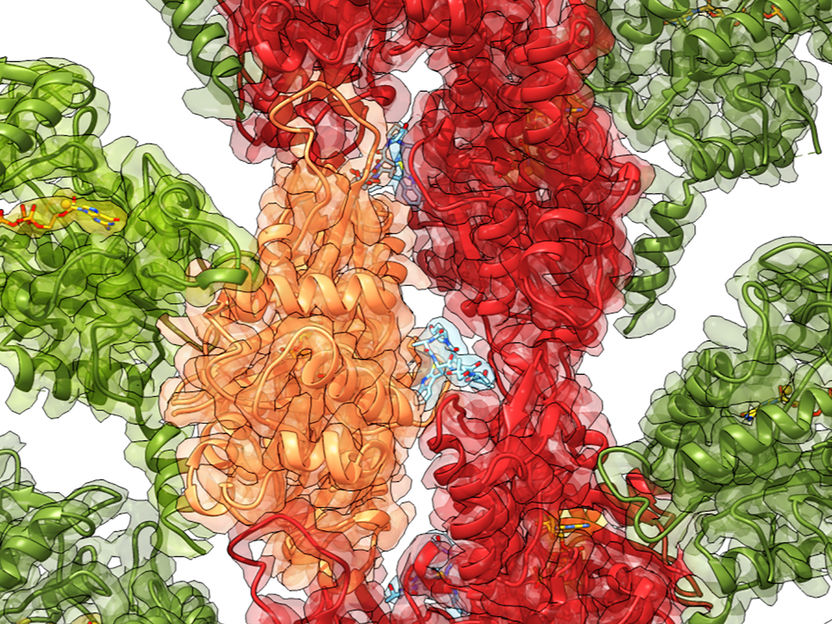
Reconstrucción por crio-EM de la toxina (verde) unida a la actina (rojo, naranja)
MPI of Molecular Physiology
Por primera vez, investigadores del Instituto Max Planck de Fisiología Molecular de Dortmund (Alemania), en colaboración con el Instituto Pasteur de París (Francia), han descubierto cómo se ordena la estructura de la toxina al interactuar con la actina, uno de los principales componentes del citoesqueleto. Parece que el acoplamiento de ExoY a la actina induce una estabilización hacia abajo en el núcleo enzimático de la toxina, que se vuelve apta para realizar su función venenosa. Los científicos utilizaron la criomicroscopía electrónica (crio-EM) y las simulaciones computacionales para obtener los detalles estructurales de las toxinas antes y después de la unión, así como ensayos enzimáticos para cuantificar la actividad de la toxina. Sus resultados se han publicado en la edición digital de la revista Nature Communications.
Stefan Raunser, director del Instituto Max Planck de Fisiología Molecular de Dortmund, y autor principal de este estudio, explica en detalle la investigación:
¿En qué consiste su descubrimiento y por qué es emocionante?
Nuestro equipo ha revelado, a nivel molecular, cómo la toxina ExoY se activa dentro de la célula al interactuar con una molécula del huésped. Curiosamente, no se trata de un efecto directo. Al ser inyectada en la célula, la toxina se acopla a los filamentos de actina, estabilizando las partes periféricas de la toxina que antes se retorcían y doblaban. Este cambio conformacional también induce una estabilización del núcleo activo de la toxina, que entonces está listo para su devastadora actividad enzimática. Llamamos a este reordenamiento a distancia "estabilización alostérica", una verdadera maravilla en biología molecular.
¿Por qué es importante su investigación para la comunidad científica?
Entender el mecanismo que hay detrás de la estabilización alostérica y cómo se produce a nivel molecular es esencial, ya que es un tema central en la regulación de las enzimas y los sistemas biomoleculares complejos. Ahora podemos decir que este modus operandi es paradigmático para varias toxinas. Por ejemplo, B. anthracis, el agente causante del ántrax, utiliza una toxina que pasa del desorden al orden de forma similar, al unirse a una proteína diferente.
¿Por qué su investigación es importante para la sociedad?
Estas toxinas son responsables de peligrosas infecciones en los hospitales y en otros lugares. En el interior de las células, utilizan su núcleo activo para perjudicar al sistema inmunitario y eludir su respuesta. El sitio activo siempre ha sido el primer objetivo para los desarrolladores de fármacos, pero ¿qué pasaría si encontramos antídotos para evitar la activación de la enzima atacando en cambio el sitio alostérico? Así pues, la comprensión de los mecanismos que subyacen a la regulación alostérica en las proteínas puede allanar el camino para el desarrollo de nuevos fármacos debido a su versatilidad para proporcionar la selectividad deseada contra las dianas proteicas al tiempo que se minimiza la toxicidad y otros efectos secundarios.
¿Qué importancia tiene la metodología que utilizó, la crio-EM, para su descubrimiento?
La crio-EM fue crucial para dilucidar cómo se une ExoY a una proteína filamentosa como la actina. Como las proteínas filamentosas no pueden cristalizarse, es imposible resolver su estructura mediante cristalografía de rayos X.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.








































