Péptidos "falsos" útiles
Los foldamers de Oligourea imitan los alfa-helices de los péptidos y se unen eficazmente a los objetivos de la droga
Algunas drogas útiles consisten en péptidos que actúan sobre sus objetivos proteicos. Para hacerlos más eficientes y estables, los científicos han encontrado una forma de reemplazar segmentos cruciales de los péptidos con unidades de ureido. Estas oligoureas, que están compuestas de unidades basadas en urea, se pliegan en una estructura similar a la de los péptidos. Los péptidos "falsos" a base de oligourea mejoran las opciones para el diseño racional de drogas, concluye el estudio publicado en la revista Angewandte Chemie.
© Wiley-VCH
Varios fármacos son péptidos que inhiben o activan las acciones de ciertas proteínas. Para mejorar su eficacia, los científicos están investigando la imitación de péptidos. Los imitadores de péptidos contienen cadenas de pequeñas unidades orgánicas que se asemejan a los aminoácidos, los componentes básicos de los péptidos, pero no son idénticos a ellos. La razón es que las enzimas proteolíticas es menos probable que ataquen estas falsas hebras de péptidos, por lo que los medicamentos serían más eficaces.
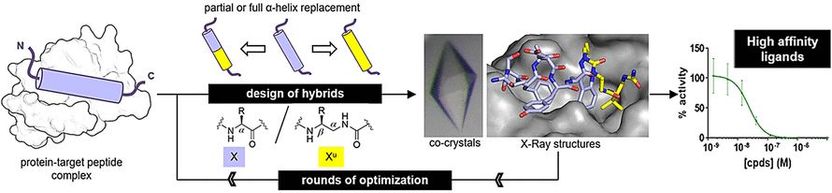
Sin embargo, las hebras sintéticas, llamadas oligómeros, deben doblarse en la estructura del péptido original para unirse a su proteína objetivo de forma adecuada. Gilles Guichard y su equipo del CNRS, Universidad de Burdeos, y sus colegas de la Universidad de Estrasburgo y de Ureka Pharma, Mulhouse, Francia, han explorado oligómeros hechos de unidades de ureido, que son derivados de la urea. Estos oligoureas se pliegan en una hélice, una de las estructuras distintivas de los péptidos. Sin embargo, hay pequeñas diferencias. "Las hélices de oligourea tienen menos residuos por vuelta, una menor elevación por vuelta y un mayor diámetro que la hélice peptídica original", dice Guichard.
Para determinar si las oligoureas podían imitar las estructuras peptídicas reales, los investigadores prepararon híbridos péptido-oligourea e investigaron su unión a las proteínas objetivo. Uno de los objetivos, MDM2, es un regulador natural de la proteína supresora de tumores p53. La otra, VDR, es una proteína necesaria para la regulación del crecimiento celular, la inmunidad y otras funciones biológicas.
Para la imitación del péptido de unión de MDM2, los investigadores prepararon híbridos sustituyendo tres aminoácidos clave terminales por unidades de ureido. Para el péptido mímico de unión VDR, reemplazaron el segmento medio de aminoácidos con unidades de ureido. Después de algunas rondas de optimización, los autores encontraron estructuras híbridas con altas afinidades de unión.
Las afinidades de unión eran similares a las de los péptidos originales. Además, el análisis de rayos X reveló que las estructuras híbridas adoptaron una estructura helicoidal regular. Sin embargo, las hélices seguían siendo un poco más anchas y tenían mayores espacios entre las cadenas laterales a lo largo de la espina dorsal de la oligourea que las de los péptidos naturales.
Se espera que los híbridos péptido-oligourea resistan la degradación proteolítica, un objetivo importante en la química médica. Otra ventaja es que permiten más modificaciones. "Los aminoácidos alfa pueden ser sustituidos en dos posiciones, pero las unidades de ureido tienen un sitio más", dice Guichard. Esto significa que las drogas híbridas péptido-oligourea ofrecen más opciones de optimización.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.




















































