El nuevo método revela cómo la proteína de la enfermedad de Parkinson daña las membranas celulares
El método permite estudiar cantidades minúsculas de moléculas biológicas sin utilizar marcadores fluorescentes
En los pacientes con la enfermedad de Parkinson, grupos de α-sinucleína (alfa-sinucleína), a veces conocida como la "proteína del Parkinson", se encuentran en el cerebro. Éstas destruyen las membranas celulares, lo que eventualmente resulta en la muerte de las células. Ahora, un nuevo método desarrollado en la Universidad Tecnológica de Chalmers, Suecia, revela cómo la composición de las membranas celulares parece ser un factor decisivo para que pequeñas cantidades de α-sinucleína causen daño.
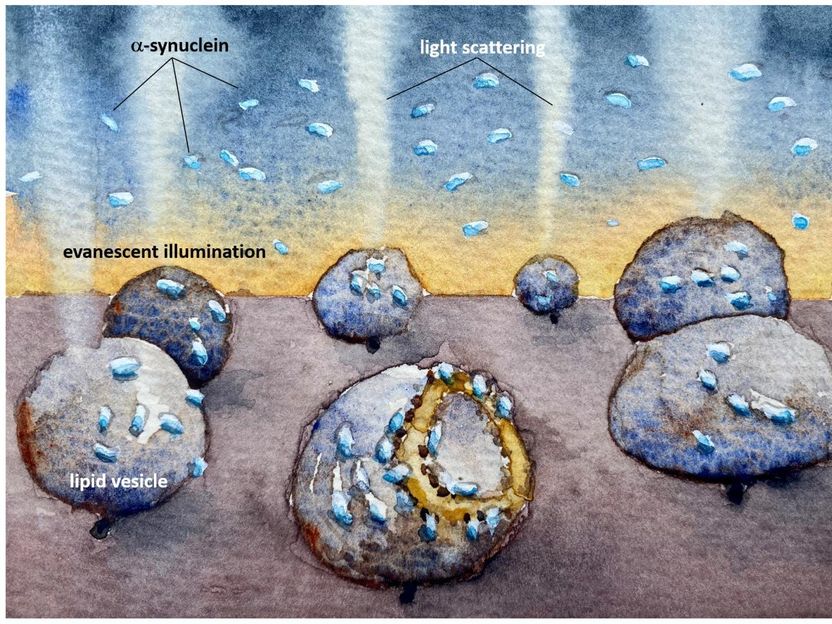
Una ilustración que muestra cómo las vesículas lipídicas que imitan a las mitocondrias son dañadas por la proteína alfa sinucleína del Parkinson. La dispersión de la luz revela cómo la membrana es destruida incluso en concentraciones muy bajas, nanomolares, donde las proteínas no se agregan a los grumos antes de unirse.
Fredrik Höök/Chalmers University of Technology
La enfermedad de Parkinson es una condición incurable en la que las neuronas, las células nerviosas del cerebro, se descomponen gradualmente y las funciones cerebrales se ven interrumpidas. Los síntomas pueden incluir sacudidas involuntarias del cuerpo, y la enfermedad puede causar grandes sufrimientos. Para desarrollar fármacos que ralenticen o detengan la enfermedad, los investigadores intentan comprender los mecanismos moleculares que subyacen a la forma en que α-synuclein contribuye a la degeneración de las neuronas.
Se sabe que las mitocondrias, los compartimentos productores de energía en las células, se dañan en la enfermedad de Parkinson, posiblemente debido a los "amiloides" de α-sinucleína. Los amiloides son grupos de proteínas dispuestos en largas fibras con una estructura central bien ordenada, y su formación es la base de muchos trastornos neurodegenerativos. Los amiloides o incluso grupos más pequeños de α-sinucleína pueden unirse y destruir las membranas mitocondriales, pero los mecanismos precisos son todavía desconocidos.
El nuevo estudio, recientemente publicado en la revista PNAS, se centra en dos tipos diferentes de vesículas parecidas a membranas, que son "cápsulas" de lípidos que pueden ser utilizadas como imitaciones de las membranas que se encuentran en las células. Una de las vesículas está hecha de lípidos que a menudo se encuentran en las vesículas sinápticas, la otra contiene lípidos relacionados con las membranas mitocondriales.
Los investigadores encontraron que la proteína del Parkinson se uniría a ambos tipos de vesícula, pero sólo causó cambios estructurales en las vesículas de tipo mitocondrial, que se deformaron asimétricamente y filtraron su contenido.
"Ahora hemos desarrollado un método que es lo suficientemente sensible para observar cómo α-sinucleína interactúa con vesículas modelo individuales. En nuestro estudio, observamos que α-sinucleína se une a - y destruye - las membranas de tipo mitocondrial, pero no hubo destrucción de las membranas de las vesículas de tipo sináptico. El daño se produce a una concentración nanomolar muy baja, donde la proteína sólo está presente como monómeros - proteínas no agregadas. Esta baja concentración de proteínas ha sido difícil de estudiar antes, pero las reacciones que hemos detectado ahora podrían ser un paso crucial en el curso de la enfermedad", dice Pernilla Wittung-Stafshede, Profesora de Biología Química en el Departamento de Biología e Ingeniería Biológica...
El nuevo método de los investigadores de la Universidad Tecnológica de Chalmers permite estudiar cantidades minúsculas de moléculas biológicas sin utilizar marcadores fluorescentes. Esto es una gran ventaja cuando se rastrean las reacciones naturales, ya que los marcadores a menudo afectan las reacciones que se quieren observar, especialmente cuando se trabaja con pequeñas proteínas como la α-sinucleína.
"Las diferencias químicas entre los dos lípidos utilizados son muy pequeñas, pero aún así observamos diferencias dramáticas en cómo α-sinucleína afectaba a las diferentes vesículas", dice Pernilla Wittung-Stafshede.
"Creemos que la química de los lípidos no es el único factor determinante, pero también que hay diferencias macroscópicas entre las dos membranas, como la dinámica y las interacciones entre los lípidos. Nadie ha mirado realmente de cerca lo que le sucede a la membrana en sí cuando α-sinucleína se une a ella, y nunca a estas bajas concentraciones".
El siguiente paso para los investigadores es investigar las variantes de la proteína α-sinucleína con mutaciones asociadas a la enfermedad de Parkinson, e investigar las vesículas lipídicas que son más similares a las membranas celulares.
"También queremos realizar análisis cuantitativos para comprender, a nivel mecánico, cómo las proteínas individuales que se reúnen en la superficie de la membrana pueden causar daños", dice Fredrik Höök, profesor del Departamento de Física, que también participó en la investigación.
"Nuestra visión es refinar aún más el método para que podamos estudiar no sólo las vesículas lipídicas individuales, pequeñas - 100 nanómetros -, sino también rastrear cada proteína una por una, aunque sólo tengan un tamaño de 1-2 nanómetros. Eso nos ayudaría a revelar cómo las pequeñas variaciones en las propiedades de las membranas lipídicas contribuyen a una respuesta tan diferente a la unión de las proteínas como la que observamos ahora".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.






















































