Fantásticas proteínas musculares y dónde encontrarlas
"Esto va a ser inesperado incluso para los investigadores de la miosina"
El propósito de identificar todas las proteínas que componen el sarcómero, la unidad básica de contracción de las células musculares, dio lugar a una revelación inesperada, proporcionando pruebas experimentales que ayudan a explicar un misterio fundamental sobre el funcionamiento de los músculos. La investigación fue publicada en Nature Communications.

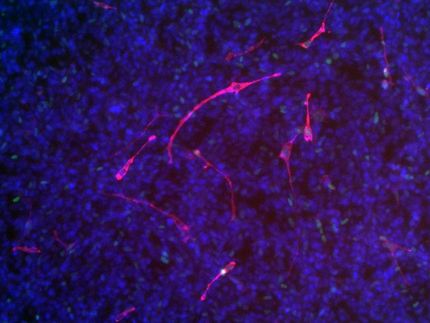
Viendo cómo se contraen los sarcómeros: collage de miosina (verde), actina y el disco Z (rojo) y BioID (azul).
© Jacobo Lopez Carballo, Gotthardt Lab, MDC
Los investigadores del Centro Max Delbrück de Medicina Molecular de la Asociación Helmholtz (MDC) desarrollaron un modelo de ratón que les permite mirar dentro de un músculo en funcionamiento e identificar las proteínas que permiten al sarcómero contraerse, relajarse, comunicar sus necesidades energéticas y adaptarse al ejercicio. Específicamente, fueron capaces de mapear las proteínas en subregiones definidas del sarcómero, empezando por el "disco Z", el límite entre los sarcómeros vecinos. Esto en sí mismo fue un paso significativo en el estudio de los músculos estriados.
En el proceso, hicieron un descubrimiento inesperado: la miosina, una de las tres principales proteínas que componen las fibras musculares estriadas, parece entrar en el disco Z. Los modelos de cómo la miosina, la actina y la proteína del andamiaje elástico trabajan juntas han ignorado en gran medida la posibilidad de que los filamentos de miosina penetren en la estructura del disco Z. Sólo recientemente los científicos alemanes han teorizado que lo hacen, pero ninguna evidencia experimental ha validado el modelo, hasta ahora.
"Esto va a ser inesperado incluso para los investigadores de la miosina", dice el profesor Michael Gotthardt, que dirige el Laboratorio de Biología Celular Neuromuscular y Cardiovascular de la MDC y dirigió la investigación. "Llega a lo más básico de cómo los músculos generan fuerza".
¿Quién está ahí?
El equipo de Gotthardt, incluyendo a los primeros autores, la Dra. Franziska Rudolph y la Dra. Claudia Fink, con la ayuda de colegas del MDC y de la Universidad de Göttingen, nunca se propusieron validar esta teoría. Su objetivo principal era identificar las proteínas en y cerca del disco Z. Para ello, desarrollaron un modelo de ratón con una enzima artificial, llamada BioID, insertada en la proteína gigante titin. El BioID de titina entonces marcó las proteínas cercanas al disco Z.
Los sarcómeros son pequeñas máquinas moleculares, llenas de proteínas que interactúan estrechamente. Hasta ahora ha sido imposible separar las proteínas específicas de las diferentes subregiones, especialmente en el músculo vivo y funcional. "Titin-BioID sondea regiones específicas de la estructura del sarcómero in vivo", dice el Dr. Philipp Mertins, que dirige el Laboratorio de Proteómica de MDC. "Esto no ha sido posible antes".
El equipo es el primero en utilizar BioID en animales vivos en condiciones fisiológicas e identificó 450 proteínas asociadas con el sarcómero, de las cuales alrededor de la mitad ya eran conocidas. Encontraron diferencias sorprendentes entre el músculo cardíaco y el esquelético, y entre los ratones adultos y los neonatos, que se relacionan con la estructura, la señalización y el metabolismo del sarcómero. Estas diferencias reflejan la necesidad del tejido adulto de optimizar el rendimiento y la producción de energía frente al crecimiento y la remodelación del tejido neonatal.
"Queríamos saber quién está ahí, saber quiénes son los jugadores", dice Gotthardt. "La mayoría eran esperados, validando nuestro enfoque".
La sorpresa
La proteína que no esperaban ver en el disco Z era la miosina, que está integrada en el sitio opuesto del sarcómero. Cuando un músculo se mueve, la miosina camina a lo largo de la actina acercando los discos Z vecinos. Este deslizamiento de los filamentos de actina y miosina crea la fuerza que permite a nuestro corazón bombear sangre o a nuestro músculo esquelético mantener la postura, o levantar un objeto.
Este llamado "modelo de filamento deslizante" del sarcómero describe la producción de fuerza y ayuda a explicar cómo se relacionan la fuerza y la longitud del sarcómero. Sin embargo, los modelos actuales tienen problemas para predecir el comportamiento de los sarcómeros totalmente contraídos. Esos modelos han asumido que la miosina no entra en el disco Z en su recorrido por la actina. Ha habido algunos indicios de que tal vez siga funcionando. "Pero no sabíamos si lo que veíamos en las muestras de tejido manchado era un artefacto o la vida real", dice Gotthardt. "Con BioID podemos sentarnos en el disco Z y ver pasar la miosina".
Gotthardt está de acuerdo con la teoría propuesta de que la miosina que entra en el disco Z puede limitar o amortiguar la contracción. Esto podría ayudar a resolver el problema actual que los científicos han tenido calculando cuánta fuerza puede crear una fibra muscular en relación con su longitud y conducir a un modelo refinado del sarcómero y posiblemente servir para proteger el músculo de una contracción excesiva.
Por qué es importante
Entender cómo las fibras musculares se extienden y contraen a nivel molecular en condiciones normales es importante para que los investigadores puedan identificar qué es lo que va mal cuando los músculos se dañan, enferman o se atrofian con la edad. Identificar qué proteínas están causando problemas podría potencialmente ayudar a identificar nuevos objetivos de tratamiento para pacientes con enfermedades cardíacas o trastornos musculares esqueléticos.
Gotthardt y su equipo planean usar el BioID para estudiar animales con diferentes patologías, para ver qué proteínas están involucradas en la atrofia muscular, por ejemplo. "Tal vez una proteína que normalmente no está ahí entra en el sarcómero, y es parte de la patología", dice Gotthardt. "Podemos encontrarla con el BioID".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.