La técnica de dos colores revela cómo los láseres de rayos X dañan las biomoléculas
Paso a una comprensión más completa de cómo los rayos X modifican la estructura de las proteínas
Los láseres de rayos X pueden revelar las estructuras espaciales de las biomoléculas que son difíciles de encontrar con otros métodos. Sin embargo, los intensos destellos de rayos X vaporizan las muestras casi inmediatamente. Un equipo internacional de científicos ha seguido ahora cómo este daño de la radiación se extiende en las biomoléculas con un detalle sin precedentes. Los resultados son importantes para el diseño e interpretación de las mediciones de rayos X con láser, como informa el equipo que incluye a la teórica de DESY, Beata Ziaja del Centro de Ciencia de Láser de Electrones Libres CFEL en la revista Nature Communications.
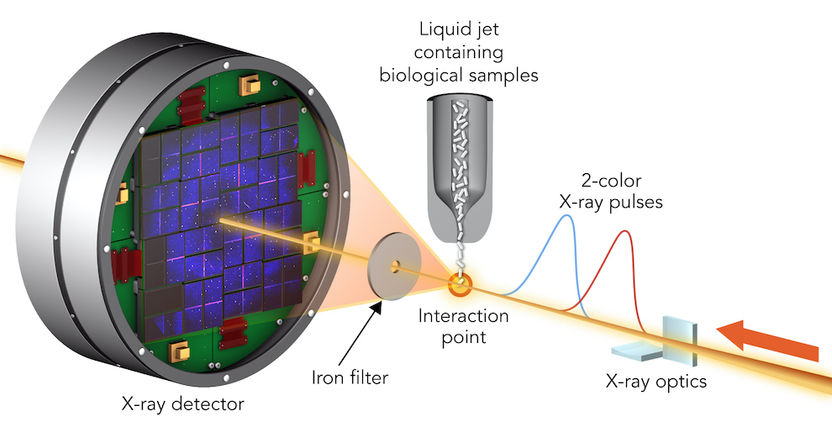
Para estudiar el daño de las muestras, los investigadores golpearon las moléculas biológicas cristalizadas con pares de pulsos de láser de rayos X que tenían longitudes de onda ligeramente diferentes y estaban separados por hasta 100 femtosegundos. El primer pulso pasó a través de la muestra y, debido a su mayor energía, fue absorbido por un filtro de papel de aluminio. El segundo se dispersó por la muestra, pasó a través del filtro y entró en un detector.
SLAC, Greg Stewart
La estructura espacial de las proteínas indica a los científicos cómo funcionan estas biomoléculas y cómo podrían ser blanco de las drogas. Para resolver la estructura, los investigadores hacen una radiografía de pequeños cristales que crecen de la proteína investigada. Los cristales difractan los rayos X de una forma característica, y a partir del patrón de difracción resultante, se puede calcular la estructura interna del cristal y sus constituyentes, las proteínas.
Numerosas estructuras proteínicas han sido resueltas de esta manera, pero algunas proteínas sólo cultivan nanocristales que necesitan luz de rayos X extra brillante para producir un patrón de difracción utilizable. Los láseres de electrones libres de rayos X (XFEL) proporcionan los destellos de rayos X más brillantes de la Tierra y permiten analizar incluso los nanocristales. Aunque los cristales se vaporizan instantáneamente, investigaciones anteriores han demostrado que el patrón de difracción supera la destrucción, por lo que la información de la estructura puede recuperarse antes de que el cristal se desintegre. Pero se desconoce en gran medida cómo se extiende el daño en las proteínas.
Gracias a una técnica de láser de rayos X de dos colores desarrollada en el láser de rayos X Linac Coherent Light Source LCLS del Laboratorio Nacional de Aceleradores de EE.UU. SLAC en California, el equipo dirigido por Ilme Schlichting del Instituto Max Planck de Investigación Médica y Sébastien Boutet de SLAC ha probado ahora la técnica hasta límites nunca antes vistos.
Los científicos encontraron dos tipos de moléculas biológicas cristalizadas, el endulzante taumatina y un complejo de lisozima (clara de huevo) con el elemento de tierras raras, el gadolinio, con pares de pulsos de rayos X láser que tenían longitudes de onda ligeramente diferentes y estaban separados por hasta 100 femtosegundos. Un femtosegundo es una millonésima de una billonésima de segundo. El primer pulso pasó a través de la muestra y fue absorbido por una lámina de hierro. El segundo tenía un color ligeramente diferente que no fue absorbido por la lámina. Se dispersó por la muestra y entró en un detector, formando un patrón de difracción que podía ser analizado para recrear la estructura de las moléculas de la muestra y medir cualquier cambio causado por el primer pulso.
"Para obtener una visión microscópica detallada de los procesos moleculares inducidos por el primer pulso de rayos X, era necesario un modelado teórico", explicó Ziaja. El equipo descubrió que las partes de una molécula que contienen átomos más pesados que el oxígeno absorbieron la mayor parte del daño de los rayos X. Las cadenas de átomos de carbono, que forman la espina dorsal de todas las proteínas, también experimentaron cambios con el tiempo, pero en un grado mucho menor. Estos cambios no fueron consistentes en toda la molécula, ocurrieron más en ciertas áreas que en otras, y aumentaron a medida que se incrementaba el tiempo entre los pulsos.
Los científicos utilizaron dos simulaciones teóricas independientes: Una del equipo DESY, compuesto por Ziaja, Malik Abdullah, Zoltan Jurek y Robin Santra, y otra de la Universidad RMIT de Melbourne y la Universidad de Melbourne, para asegurarse de que las conclusiones no estuvieran sesgadas. "Ambas simulaciones independientes confirmaron el daño de la radiación que progresaba selectivamente y que afectaba principalmente a los iones de azufre, cargándolos fuertemente", dijo Ziaja. "También demostraron que la dinámica correlativa de los iones de azufre altamente cargados era mucho más lenta de lo previsto, debido al importante impacto del entorno microscópico que rodea a los iones".
Estos resultados muestran que para hacer mediciones fiables, los investigadores necesitan modelar las partes específicas de una muestra en lugar de asumir que todas las partes de la molécula están igualmente dañadas. El estudio marca el comienzo de una comprensión más completa de cómo los pulsos de rayos X muy cortos producidos por los láseres de rayos X modifican la estructura de las moléculas biológicas.
El equipo llegó a la conclusión de que la "difracción antes de la destrucción" es un método eficaz para determinar la estructura de las moléculas biológicas, siempre que los científicos tengan en cuenta la intensidad y la duración de los pulsos utilizados para estudiarlas al interpretar sus resultados. "Nuestro análisis muestra que se necesita claramente una comprensión más profunda de los efectos de los daños locales para informar el diseño de los estudios del XFEL de tales sistemas y asegurar la correcta interpretación de los resultados para obtener información química precisa", explicó Ziaja.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.