Passende Teilchen für Biosensoren
Forschung und Industrie erschließen zunehmend das Potential von Aptameren. Neben ihrer Anwendung in Forschung, medizinischer Diagnostik und Therapie sind diese auch interessant als Basis von Biosensoren für die Umweltanalytik, denn sie können aufgrund ihrer Eigenschaften Zielmoleküle wie ein Schlüssel sein Schloss erkennen und binden. Forscherinnen des Helmholtz-Zentrums für Umweltforschung (UFZ) haben jetzt in einem neuen Fachbuch die Methoden der Aptamer-Gewinnung beschrieben. Ein gerade bewilligtes Projekt zielt auf die Entwicklung neuer nanostrukturierter Biosensoren für die Messung von Schadstoffen in Wässern.
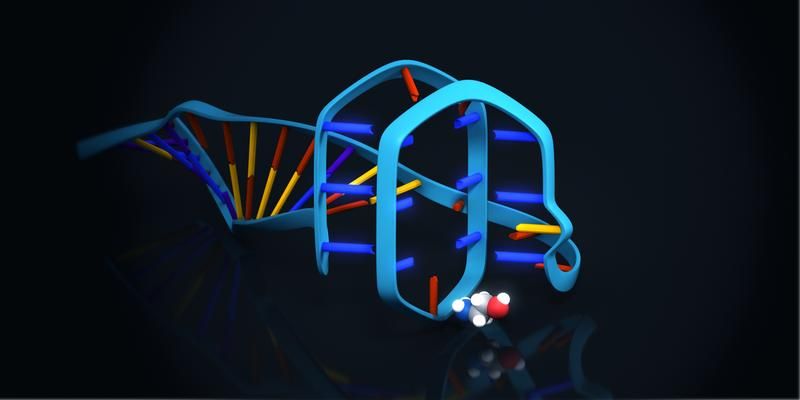
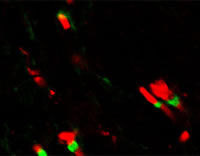
3-D-Modell des Ethanolamin-Aptamers. Das kleine Ethanolamin-Molekül wird an einem Sequenzbereich des Aptamers gebunden, der eine G-Quadruplex-Struktur bildet. Modellhafte Darstellung einer möglichen Variante der Bindung zwischen Aptamer und Zielmolekül.
Ronny Jesse/www.jesse3d.de
Der Begriff Aptamere bedeutet soviel wie "passende Teilchen" (aptus = lat. für passend; meros = griech. für Teilchen). Aptamere bestehen aus Nukleinsäuren und können bestimmte Zielmoleküle auf Grund ihrer dreidimensionalen Gestalt erkennen und anschließend binden. Durch diese Bindung wird z.B. das Aufspüren, Nachweisen und Messen bestimmter Stoffe möglich. Dazu können die Aptamere beispielsweise in Biosensoren eingesetzt werden. Biosensoren versprechen einfache, schnelle und kostengünstige Messungen. Das Herzstück eines jeden Biosensors ist eine biologisch aktive Komponente. Dieser Biorezeptor ist in der Lage, mit seinen Zielsubstanzen in Wechselwirkung zu treten und dabei ein Signal zu erzeugen. Über bestimmte im Sensor enthaltene Signalwandler wird dieses Signal dann sicht- und messbar gemacht. Nach der Messung wird der Biosensor wieder in seinen Ausgangszustand gebracht. Das bedeutet: er ist regenerierbar.
Um solche Biosensoren konstruieren zu können, werden jedoch geeignete Biorezeptoren gebraucht, die die gesuchte Substanz erkennen. Aptamere haben hier ein großes Potential, als biologische Erkennungselemente in Biosensoren genutzt zu werden. Dazu muss aber zunächst für ein bestimmtes Zielmolekül das passende Aptamer gefunden werden. Zielmoleküle können dabei sowohl sehr komplexe Gebilde, wie ganze Zellen oder Organismen sein, als auch ganz winzige Moleküle, die nur aus wenigen Atomen bestehen. Die Suche nach den passenden Aptameren gleicht einer gigantischen "Partnerschaftsvermittlung auf molekularer Ebene". Aus einer unüberschaubar großen Bibliothek von 1.015 (also 10 Millionen mal 100 Millionen) Nukleinsäuren unterschiedlicher Sequenz werden mit einem in vitro-Verfahren die am besten passenden Bindungspartner für das jeweilige Zielmolekül "herausgesucht". Diese Selektionsmethode heißt SELEX (Systematische Evolution von Liganden durch EXponentielle Anreicherung). Hierbei handelt es sich um einen evolutiven Prozess, der in vitro stattfindet. Das heißt, der Einsatz von Tieren, Pflanzen oder Zellkulturen ist nicht notwendig. Neben ethischen Gründen bietet dies zusätzlich den Vorteil, dass auch Aptamere für giftige Stoffe selektiert werden können. Wenn für ein Zielmolekül geeignete Binder (Aptamere) mittels des SELEX-Verfahrens gefunden und ihre Sequenzen bestimmt wurden, können sie jederzeit mit hoher Genauigkeit und Reproduzierbarkeit chemisch synthetisiert werden. Dies bedeutet auch, dass bei der Synthese keine biologisch bedingten Schwankungen einkalkuliert werden müssen wie bei der Gewinnung aus natürlichen Systemen. Ein weiterer Vorteil besteht darin, dass die Aptamere durch Sequenzmodifikationen bzw. das Anfügen funktioneller Gruppen oder Reportermolekülen relativ einfach mit definierten Eigenschaften versehen werden können. Das können Eigenschaften sein, die ein Nachweisverfahren überhaupt erst ermöglichen, es vereinfachen oder die zur Erhöhung der Stabilität beitragen.
In dem von Dr. Beate Strehlitz geleiteten Biosensor-Labor des UFZ hat Dr. Regina Stoltenburg mittlerweile zwei verschiedene Modifizierungen des SELEX-Verfahrens etabliert. Eine davon ist der sogenannten FluMag-SELEX. Das "Flu" kommt dabei von Fluoreszenz und bedeutet, dass die Nukleinsäuren während des SELEX-Verfahrens mit einem Fluoreszenzmolekül versehen und damit sichtbar gemacht werden. Damit können die Moleküle immer wieder gefunden und die Anreicherung jener Binder (Aptamere) gemessen werden, die besonders gut das Zielmolekül erkennen und binden. Das "Mag" kommt von "Magnetic Beads". Das sind stäubchengroße magnetische Kügelchen, auf denen die Wissenschaftlerinnen die vergleichsweise winzigen Zielmoleküle "aufkleben", damit diese besser handhabbar werden.
Es gibt eine ganze Reihe weiterer Modifizierungen des SELEX-Verfahrens, die von Arbeitsgruppen aus Forschungseinrichtungen in allen Teilen der Welt entwickelt wurden, mit dem Ziel, Aptamere für die unterschiedlichsten Anwendungen zu selektieren. In dem Fachbuch "Aptamers in Bioanalysis" haben Beate Strehlitz und Regina Stoltenburg ein Übersichtskapitel über das SELEX-Verfahren und seine vielfältigen Varianten geschrieben. Mit dem FluMag-SELEX der Leipziger Forschergruppe können Aptamere für eine breite Palette an Zielmolekülen selektiert werden. Bisher gelang das für ganz unterschiedliche Moleküle: für ein Protein, ein Peptid und für Ethanolamin, das bislang kleinste Zielmolekül, für das jemals ein Aptamer gefunden wurde. Die Ethanolamin-bindenden Aptamere wurden patentiert. Ebenfalls gelang Dr. Christine Reinemann die Aptamerselektion für einen Extrakt aus den Sporen des Schimmelpilzes Penicillim expansum. Sie hofft, in einem vom Sächsischen Landesamt für Umwelt, Landwirtschaft und Geologie (LfULG) geförderten Drittmittelprojekt eine Detektionsmethode für Schimmelpilze entwickeln zu können, denn diese sind eine der Ursachen dafür, dass Allergien in Deutschland immer mehr zunehmen. Innerhalb der Internationalen Wasserforschungsallianz Sachsen (IWAS) möchte Dr. Regina Stoltenburg zusammen mit dem Doktoranden Sören Linkorn und Forschern des Institutes für Lebensmittel- und Bioverfahrenstechnik der TU Dresden Aptamere selektieren, die pathogene Bakterien erkennen können und darauf aufbauend eine biosensorische Nachweismethode für Krankheitserreger in Wässern entwickeln. Eine schnelle Methode zur Bestimmung solcher gefährlichen Keime ist besonders in wasserarmen Regionen der Welt wichtig, weil dort verseuchtes Trinkwasser vorkommt und zu Krankheiten, Todesfällen oder gar Epidemien führen kann.
Ganz aktuell wurde vom Bundesministerium für Bildung und Forschung (BMBF) ein Kooperationsprojekt unter der Leitung des Forschungszentrums Dresden-Rossendorf (FZD) und in Kooperation mit der Universität Rostock, der proaqua GmbH & Co. KG Mainz und dem UFZ bewilligt, welches sich in das Forschungsprogramm "BIONA - Bionische Innovationen für nachhaltige Produkte" und Technologien integriert. In diesem Projekt sollen die natürlichen Nanostrukturen bakterieller Hüllproteine für eine geordnete Fixierung von Aptameren auf Sensoroberflächen genutzt werden. Die am UFZ zu entwickelnden Aptamere sollen bestimmte organische Substanzen wie Arzneimittelreststoffe, die über das Abwasser in die Umwelt geraten und dort nicht erwünscht sind, erkennen können.
Haben die UFZ-Forscher Erfolg, dann können Biosensoren in ein paar Jahren dazu beitragen, potenzielle Gesundheitsgefahren wie Schimmelpilze in Räumen oder Krankheitskeime und Arzneimittelreststoffe im Wasser rechtzeitig zu erkennen.
Originalveröffentlichung: Strehlitz, B., Stoltenburg, R.; "SELEX and its Recent Optimizations" in: Mascini, M.; "Aptamers in Bioanalysis"; WILEY Interscience 2009
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Diagnostik
Die Diagnostik ist das Herzstück der modernen Medizin und bildet in der Biotech- und Pharmabranche eine entscheidende Schnittstelle zwischen Forschung und Patientenversorgung. Sie ermöglicht nicht nur die frühzeitige Erkennung und Überwachung von Krankheiten, sondern spielt auch eine zentrale Rolle bei der individualisierten Medizin, indem sie gezielte Therapien basierend auf der genetischen und molekularen Signatur eines Individuums ermöglicht.

Themenwelt Diagnostik
Die Diagnostik ist das Herzstück der modernen Medizin und bildet in der Biotech- und Pharmabranche eine entscheidende Schnittstelle zwischen Forschung und Patientenversorgung. Sie ermöglicht nicht nur die frühzeitige Erkennung und Überwachung von Krankheiten, sondern spielt auch eine zentrale Rolle bei der individualisierten Medizin, indem sie gezielte Therapien basierend auf der genetischen und molekularen Signatur eines Individuums ermöglicht.