Was Stammzellen zu Stammzellen macht
Dresdner Forscher finden neue Gene, die lenken, wann embryonale Stammzellen pluripotent bleiben oder ausdifferenzieren
Induzierte pluripotente Stammzellen (iPS-Zellen) gleichen embryonalen Stammzellen in einer entscheidenden Eigenschaft: Sie können jeden Zelltyp ausbilden, sind also - wie der Name schon sagt - pluripotent. Deshalb gehört diesen iPS-Zellen möglicherweise die Zukunft in der Medizin - für therapeutische Ansätze im Kampf gegen neuronale Erkrankungen, als Therapie gegen Diabetes oder Lebererkrankungen. "Genau wegen ihres hohen medizinischen Potenzials wollen wir Stammzellen und iPS-Zellen noch besser verstehen: Welche Faktoren lassen in ihnen das embryonale Programm ablaufen und steuern ihre Pluripotenz?", sagt Frank Buchholz. Seine Arbeitsgruppe am Max-Planck-Institut für Molekulare Zellbiologie und Genetik in Dresden hat nun in einem genomweiten Screen alle Gene in Säugetierstammzellen gesucht, die die Expression von Oct4 modulieren. Dieses Protein reguliert, ob eine Zelle pluripotent bleibt oder eine Zellentwicklung eingeleitet wird. Dabei haben sie 296 Treffer gelandet. Dieser neue Datensatz gibt Aufschluss darüber, welche Gene eine Stammzelle braucht, um eine Stammzelle zu bleiben.
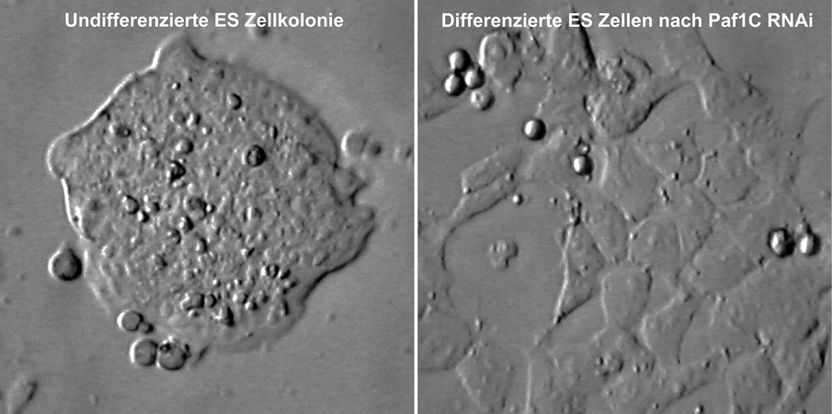
Mikroskopische Aufnahmen von undifferenzierten und differenzierten ES Zellen. Das rechte Bild zeigt die Differenzierung der ES Zellen nach Paf1C RNAi.
Max-Planck-Institut für Molekulare Zellbiologie und Genetik
Embryonale Stammzellen sind unsterbliche Multitalente - sie vermehren sich unbegrenzt und sie besitzen das Potenzial, jeden Zelltyp des erwachsenen Organismus auszubilden. Diese Pluripotenz macht sie für die Medizin interessant: Sie könnten als Ausgangsmaterial für hochspezialisierte Zellen - wie z.B. Nervenzellen - genutzt und gezüchtet werden, und nach einer Transplantation kranke und kaputte Zellen oder gar ganze Gewebe und Organe ersetzen. Für viele Krankheiten ist dieser Therapieansatz jedoch noch Zukunftsvision. Vor allem aber überwiegt das ethische Problem ihrer Gewinnung: Sie werden aus der Blastozyste, dem vier bis sieben Tage altem Embryo, entnommen - und dieser Embryo wird dabei zerstört.
Bei iPS-Zellen ist das anders. Auch sie sind Alleskönner - pluripotente Zellen. Doch sie haben einen großen Vorteil: Sie werden aus bereits ausdifferenzierten Zellen, zum Beispiel Hautzellen, gewonnen, die Forscher genetisch so verändern können, dass das embryonale Programm wieder eingeschaltet wird. Dies umgeht den ethischen Konflikt, der bei der Gewinnung von embryonalen Stammzellen besteht: Für iPS-Zellen muss kein Embryo zerstört werden. Erstaunlicherweise braucht man für die Umprogrammierung einer somatischen in eine iPS-Zelle nur wenige Faktoren, manchmal sogar nur einen. Der wichtigste Faktor hierbei wird von dem Gen Oct4 kodiert. So verwandeln sich neuronale Stammzellen zurück zu iPS-Zellen, wenn man artifiziell Oct4 in ihnen exprimiert.
Der Screen, den die Arbeitsgruppe um Frank Buchholz durchgeführt hat, offenbarte 296 Gene, die beeinflussen, wie konzentriert das Gen Oct4 in einer Zelle auftritt, ob die Zelle also pluripotent bleibt oder eine Ausreifung zu einer bestimmten Zellart einleitet. Da mithilfe von Oct4 iPS-Zellen herstellt werden können, liefern die Dresdner Forscher damit wichtige Anhaltspunkte, wie der Umprogrammierungsprozess in Zukunft perfektioniert werden kann. "Nur wenn wir die Balance aus Selbsterneuerung und Ausreifung von Stamm- und iPS-Zellen detailliert und systematisch verstanden haben, können wir für die Zukunft auch wirklich sichere Zellersatz-Therapien ohne Tumor-Risiko entwickeln", erläutert Buchholz.
Darüber hinaus haben sich die Forscher einen Proteinkomplex besonders genau angeschaut: Paf1C. "Wir fanden heraus, dass dieser Komplex das Verhalten einer Stammzelle reguliert: Er bindet an viele Promotoren, also die Startbereiche von bestimmten Pluripotenz-Schlüsselgenen, wie z.B. dem Oct4-Gen. Wird Paf1C ausgeschaltet, produziert die Zelle weniger von den Pluripotenz-Schlüsselgenen - die Stammzelle differenziert. Ist Paf1C aber in erhöhten Mengen in der Stammzelle vorhanden, wird eine Ausreifung der Zelle blockiert - die Zelle bleibt embryonal, also pluripotent", erklärt Buchholz.
Originalveröffentlichung: Li Ding et al.; "A Genome-Scale RNAi Screen for Oct4 Modulators Defines a Role of the Paf1 Complex for Embryonic Stem Cell Identity"; Cell Stem Cell, 2. April 2009