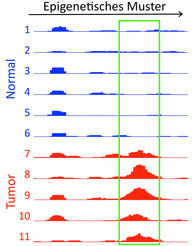
DNA-Duplikation führt zur Kurzfingrigkeit
Wie viele und wie lange Glieder ein Zeigefinger besitzt, wird von einer nicht-kodierenden Sequenz im Genom gesteuert
Das menschliche Erbgut besteht insgesamt aus 3,3 Milliarden Bausteinen, von denen nur etwa zwei Prozent für lebenswichtige Proteine kodieren. Die Funktion der übrigen 98 Prozent, die sich aus nicht-kodierenden Sequenzen zusammensetzt, ist bisher weitgehend unbekannt. Mittels einer neuen Methode haben Berliner Wissenschaftler jetzt in diesen bisher wenig untersuchten Bereichen den Schlüssel für einen neuen Krankheitsmechanismus entdeckt, der zu einer seltenen Fehlbildungen der Hand führt. Das Überraschende dabei: Normalerweise wird diese durch klassische Genmutationen bedingt. Als weitere Ursache kommt allerdings auch die DNA-Verdopplung einer Regulatorsequenz in Frage, wie die Forscher jetzt herausgefunden haben. Diese Duplikation liegt in einer evolutionär hoch konservierten Sequenz des Genoms, die bei verschiedenen Spezies, unter anderem beim Huhn und bei der Maus, nahezu identisch ist.
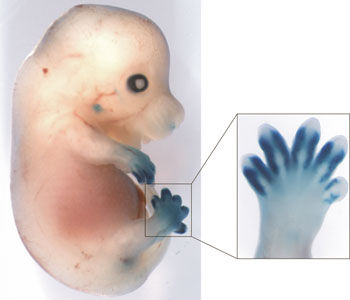
Am genetisch veränderten Mäuseembryo beobachten die Forscher erstmalig die Enhancer-Aktivität eines Regulator-Elementes, das die Musterbildung der Hand steuert
Max-Planck-Institut für molekulare Genetik
Unsere Hand ist ein Meisterwerk der Natur, mit der wir die Welt begreifen. Auch ihre embryonale Entwicklung ist äußerst komplex. Viele Fragen sind noch offen: Warum beispielsweise besteht der Daumen aus zwei Gliedern, wohingegen die anderen Finger dreigliedrig sind? Wie wird bereits im Embryo dieser Bauplan so gesteuert, dass die Hand später optimal greifen kann? Ein Puzzlestück in diesem komplizierten Steuerungsprozess konnte nun durch Wissenschaftler der Charité-Universitätsmedizin Berlin und des Berliner Max-Planck-Institutes für molekulare Genetik mit Kollegen aus Hamburg, Köln, Dänemark und Brasilien aufgeklärt werden.
Die Wissenschaftler haben dazu eine Familie untersucht, bei der das Mittelglied des Zeigefingers verkürzt war und teilweise ganz fehlte (Brachydaktylie vom Typ A2; von griechisch brachys = kurz, dactylos = Finger). Diese Kurzfingrigkeit vom Typ A2 ist eine genetische Störung, die autosomal dominant, also von Eltern an ihre Kinder mit einer Wahrscheinlichkeit von 50 Prozent weitervererbt werden kann. Dabei führt eine Veränderung im Erbgut zu einer fehlerhaften Entwicklung der einzelnen Fingerglieder während der Embryonalphase. Die genetische Ursache für diese Störung ist heterogen, das heißt unterschiedliche Mutationen können die gleichen Veränderungen bewirken. Vor allem Mutationen innerhalb einer spezifischen Signalkaskade, die das Protein "Growth Differentiation Factor 5" (GDF5) und den entsprechenden Rezeptor (BMP Rezeptor 1B) betreffen, spielen hierbei eine wesentlichen Rolle.
Als weitere Ursache konnten die Wissenschaftler Stefan Mundlos und Eva Klopocki jetzt allerdings auch eine winzige Verdopplung in den nicht-kodierenden Sequenzen des Erbguts identifizieren. Innerhalb dieser Duplikation befindet sich kein Gen im klassischen Sinn, sondern ein Regulator, ein so genanntes "Enhancer"-Element. Dieses kontrolliert - über eine weite Strecke hinweg - ein Gen (BMP2, "Bone morphogenetic Protein 2"), das entscheidenden Einfluss auf die Musterbildung der Hand und der Finger hat.
Dabei waren die Forscher überrascht, dass nicht Veränderungen im BMP2-Gen selbst, sondern im Regulator zu einer Fehlregulation und damit zu der gestörten Musterbildung der Finger führte. Damit konnten sie nachweisen, dass auch Veränderungen in den früher als unbedeutend erachteten nicht-kodierenden DNA-Bereichen ursächlich für die Entstehung von Krankheiten sein können.
Mithilfe von vergleichender Gen-Analyse von betroffenen und nichtbetroffenen Familienmitgliedern (Kopplungsanalyse) wurde das Merkmal für die kritische Region nachgewiesen. Ergänzend dazu kam eine neue Methode zum Einsatz, die sogenannte hochauflösende Mikroarray-basierte komparative genomische Hybridisierung (Array-CGH, "Gen-Chip"). Damit konnten die Forscher in dem identifizierten Abschnitt eine sehr kleine, 5,5 Kilobasen umfassende pathogene Duplikation von genetischem Material identifizieren, die letztendlich für die Entstehung der Kurzfingrigkeit verantwortlich ist.
"Die Verdopplung des regulatorischen Elementes, das während der Embryonalentwicklung die präzise Steuerung von Genen beeinflusst, stört das Gleichgewichtes im BMP-Signalweg während der initialen Entwicklung der Finger empfindlich", erklärt Stefan Mundlos, der Leiter des Forschungsprojektes. "Mit der Identifizierung dieses Regulators haben wir einen weiteren Teil des komplexen Netzwerkes bei der Hand- und Fingerentwicklung verstanden." Der Forscher erwartet nun, dass in Zukunft durch neue Technologien, wie die Array-CGH oder die Hochdurchsatz-Sequenzierung ("Next generation sequencing") weitere Veränderungen in nicht-kodierenden Sequenzen als Ursache für angeborene Fehlbildungen entdeckt werden.
Originalveröffentlichung: Dathe, K., Kjaer, K.W., Brehm, A., Meinecke, P., Nürnberg, P., Neto, C.G., Brunoni, D., Tommerup, N., Ott, C.-E., Klopocki, E., Seemann, P., Mundlos, S.; "Duplications involving a conserved regulatory element downstream of BMP2 are associated with brachydactyly type A2"; American Journal of Human Genetics 2009.