Schutz vor Stress durch Hsp90
Wenn Zellen in Stress geraten, leistet das Eiweiß Hsp90 einen wichtigen Beitrag dazu, dass sie überleben. Die Arbeitsweise dieses Proteins haben nun zwei Gruppen der Technischen Universität München (TUM) aufgeklärt.
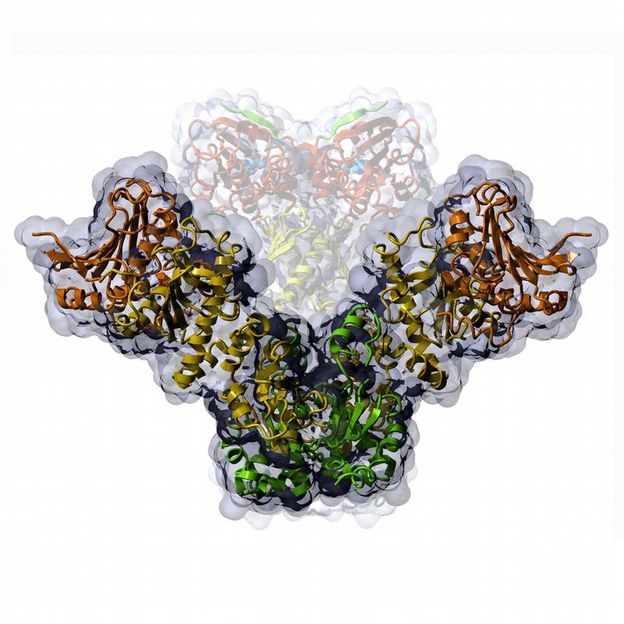
Das Bild zeigt die scherenartige Bewegung des Proteins Hsp90 in der offenen und der geschlossenen Form (Hintergrund).
TUM
Proteine sind die Maschinen der Zelle. Sie erfüllen vielfältige Aufgaben, wie zum Beispiel den Transport von Molekülen, die Bewegung von Muskeln, die chemische Umwandlung von Stoffen oder auch die Faltung anderer Proteine. Das so genannte Hitzeschockprotein Hsp90 ist für unsere Zellen von zentraler Bedeutung, da es viele grundlegende Prozesse entscheidend steuert. Es ist zum Beispiel maßgeblich daran beteiligt, dass einfache Aminosäureketten zu funktionierenden Proteinen mit einer genau definierten räumlichen Struktur gefaltet werden. Vor allem dann, wenn die Zelle durch Hitze, Vergiftungen oder Sauerstoffmangel hohem Stress ausgesetzt ist, wird das Protein vermehrt hergestellt, um die Schäden in Grenzen zu halten.
Die notwendige Energie für seine Funktion gewinnt Hsp90 durch die langsame Spaltung von ATP. Dabei ändert sich die Gestalt des Proteins. Wie bei einer makroskopischen Maschine bewegen sich einzelne Teile gegeneinander, allerdings nur um einige Nanometer. Zwei Arbeitsgruppen der TUM, um Professor Johannes Buchner aus der Chemie und Professor Thorsten Hugel aus der Physik, haben diese scherenartige Bewegung nun zum ersten Mal in Echtzeit verfolgt und die einzelnen Schritte des Reaktionsmechanismus aufgeklärt.
Um diese Veränderungen im Nanometerbereich verfolgen zu können, wurden zwei fluoreszierende Farbstoffmoleküle an exakt definierten Stellen im Protein angebracht und als molekulares Lineal benutzt: Beleuchtet man einen Farbstoff, so bringt dieser den zweiten Farbstoff umso heller zum Leuchten, je näher er an diesem ist. Mit Hilfe dieser Technik (FRET) konnte sogar die Bewegung einzelner Hsp90 Moleküle analysiert werden.
Wichtige und unerwartete Ergebnisse sind zum Einen, dass der Prozess in einer Reihe von wohl definierten Teilschritten abläuft und dass nur ein Teil der Energie in mechanische Arbeit, also Bewegung, umgesetzt wird. Interessanterweise beeinflussen Helferproteine die Kopplung zwischen "Kraftstoffverbrauch" und Bewegung im Protein. Die Bewegung wird dabei beschleunigt oder gebremst.
Diese Ergebnisse sind nicht nur für das grundsätzliche Verständnis von molekularen Maschinen von Bedeutung, sondern auch für die Pharmaforschung, da Hsp90 ein interessantes Zielprotein für die Krebstherapie ist. Wenn es gelingt die Maschine kontrolliert abzuschalten, dann könnte man die Teilung von Krebszellen stoppen.
"Diese beiden Arbeiten zeigen sehr schön, wie wichtig inzwischen die interdisziplinäre Zusammenarbeit geworden ist und wie gut sie hier auf dem Campus funktioniert," sagt Buchner. "Hier haben die beiden TUM Departments Physik und Chemie, die beiden Exzellenzcluster CIPSM und NIM sowie das Zentralinstitut für Medizintechnik (IMETUM) aufs engste zusammengearbeitet. Für eine einzelne Arbeitsgruppe sind solche Ergebnisse nicht zu erzielen."
Die Arbeiten wurden durch die Deutsche Forschungsgemeinschaft (SFB 594), den Fonds der Chemischen Industrie und die beiden Exzellenzcluster Nanoinitiative München (NIM) und Munich Center for Integrated Protein Science (CIPSM) unterstützt.
Originalveröffentlichungen: Martin Hessling, Klaus Richter, Johannes Buchner; "Dissection of the ATP-induced conformational cycle of the molecular chaperone Hsp90"; Nature Structural & Molecular Biology, Published online 22 February 2009
Moritz Mickler et al.; "The large conformational changes of Hsp90 are only weakly coupled to ATP hydrolysis" Nature Structural & Molecular Biology, Published online 22 February 2009