Evolution bringt Doppelgänger-Enzym hervor
Nervenzellen reden miteinander. Dies geschieht an ihren Kontaktstellen, den Synapsen, von denen es zwei in ihrem Aufbau fundamental unterschiedliche Typen gibt: die chemischen Synapsen, die Botenstoffe in Form von Neurotransmittern benutzen, und die elektrischen Synapsen, die eine Art Kanalsystem zwischen Nervenzellen bilden und eine direkte Übertragung von elektrischen Impulsen ermöglichen. Fast sämtliche höhere Hirnfunktionen wie Lernen, Gedächtnisspeicherung und Steuerung von Gefühlen wurde auf die Fähigkeit von chemischen Synapsen zurückgeführt, auf eine Ansprache (Nervenreiz) so zu reagieren, dass Erinnerungsspuren gebildet oder vorhandene abgerufen werden können. Hierbei spielt ein Schlüsselenzym eine entscheidende Rolle, das die Fähigkeit besitzt, auf einen kurzen Reiz mit einer langanhaltenden Änderung seiner Aktivität zu reagieren. Bisher wurde dieses Enzym fast ausschließlich an chemischen Synapsen gefunden. Einem internationalen Team von Neurowissenschaftlern und Molekularbiologen aus Bochum um Prof. Dr. Rolf Dermietzel, Bonn um Prof. Dr. Klaus Willecke sowie aus New York um Prof. Dr. David Spray gelang es nun zu zeigen, dass beide Synapsentypen das gleiche Schlüsselenzym benutzen.

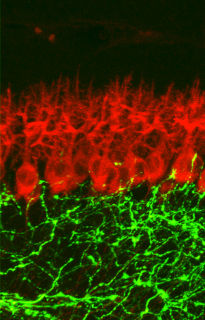
Fluoreszenzmikroskopische Aufnahme der Kolokalisation des Schlüsselenzyms CaMKII und des Kanalproteins Cx36 von elektrischen Synapsen in einem Schnitt des Hirnstammes. Darüber projiziert ein Modell der molekularen Interaktion beider Proteine.
Ruhr-Universität Bochum
Ein wesentliches Merkmal, das chemische Synapsen für die Ausbildung von Gedächtnisspuren nutzen, ist die synaptische Plastizität. "Hierunter verstehen wir die Fähigkeit der Synapsen, in Abhängigkeit der Stärke und Dauer eines Nervenreizes mit einer langanhaltenden Veränderung ihrer Aktivität zu reagieren, was dazu führen kann, dass sich das Muster neuronaler Verschaltungen ändert", erklärt Prof. Dermietzel. Einer der wichtigsten Botenstoffe, der bei der synaptischen Plastizität eine Rolle spielt, ist der Botenstoff Glutamat, eine kleine Aminosäure. Sie reagiert an der chemischen Synapse mit Rezeptoren, die bei Aktivierung für unterschiedliche geladene Teilchen (Ionen) durchlässig werden. Calcium ist eines der wichtigsten Ionen, das bei Aktivierung eines bestimmten Glutamatrezeptors (NMDA-Rezeptor) in die Nervenzelle einströmt und das Schlüsselenzym CaMKII aktiviert.
Die Forscher entdecken nun eine überraschende molekulare Ähnlichkeit des elektrischen Synapsenproteins (Cx36) mit einer Untereinheit des für die Gedächtnisbildung entscheidenden NMDA-Rezeptors. Obwohl beide Moleküle im Aufbau vollkommen unterschiedlich sind, haben sich offenbar im Laufe der Evolution identische Bindungsstellen für das Schlüsselenzym heraus kristallisiert, die es beiden Synapsentypen erlauben diesen molekularen Schalter für Gedächtnisbildung gemeinsam zu nutzen. "Eine Entdeckung, die für uns alle vollkommen unterwartet kam, und die zeigt, wie effizient die Evolution mit ihren Ressourcen umgeht", sagt Prof. Dermietzel. "Wir erwarten von dieser Entdeckung einen Quantensprung in der weiteren Erforschung der Funktion von elektrischen Synapsen, die jahrelang eine Art Aschenputteldasein im Forschungskanon der Neurowissenschaften geführt haben." Es sei nicht auszuschließen, dass sich hierdurch auch neue Erkenntnisse im Bereich neurologischer Erkrankungen wie Epilepsie und Schlaganfall ergeben, bei denen eine Beteiligung von elektrischen Synapsen diskutiert wird.
Originalveröffentlichung: Cantas Alev et al; "The neuronal gap junction protein Cx36 interacts with and is phosphorylated by CaMKII in a way similar to CaMKII interaction with glutamate receptors"; Proc. Natl. Acad. Sci. (USA), 15. December 2008
Meistgelesene News
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte

Beiges Fett "unverzichtbar" für den Schutz des Gehirns vor Demenz
Kontrollierte Ablösung schichtweise aufgebauter Filme:Neue Wege für eine gesteuerte Pharmaka-Freisetzung? - Selbstzerstörung als Prinzip

Polyethersulfone Microfilter | Mikrofilter | Sartorius
Gleichgewicht finden: Mechanismus zur Kontrolle von Autoimmunität entdeckt

Das Gehirn erstellt drei Kopien für eine einzige Erinnerung
Eine giftige Kugel, die an der bakteriellen Konkurrenz beteiligt ist
Burmanniaceae
Analyticon/Biocon Umsatzerhöhung durch Synergie
MEDLINE