Schlafende Stammzellen für den Notfall
Eine kleine Gruppe von Stammzellen im Knochenmark verschläft fast das ganze Leben. Erst Verletzungen oder Blutverlust erwecken sie zur Aktivität: Unverzüglich beginnen sie mit der Zellteilung, bis der Verlust an Blutzellen wieder ausgeglichen ist. Die Möglichkeit, diese schlafenden Stammzellen gezielt aufzuwecken, eröffnet neue Perspektiven für die Krebstherapie, wie Wissenschaftler aus dem Deutschen Krebsforschungszentrum sowie aus der Ecole Polytechnique Fédérale und dem Ludwig Institute for Cancer Research in Lausanne in den neuesten Ausgaben der Zeitschriften "CELL" und "CELL Stem Cell" veröffentlichen.
Viele spezialisierte Zellen, etwa in der Haut, Darmschleimhaut oder im Blut, haben nur eine Lebensspanne von wenigen Tagen. Für die Funktionsfähigkeit dieser Gewebe ist daher ein steter Nachschub an spezialisierten Zellen unerlässlich. Zuständig dafür sind die sogenannten „adulten“ Stammzellen, die auch als Gewebestammzellen bezeichnet werden.
Stammzellen zeichnen sich durch zwei entscheidende Charakteristika aus: Sie können zu all den verschiedenartigen Zelltypen ausdifferenzieren, aus denen ihr jeweiliges Gewebe aufgebaut ist – eine Eigenschaft, die man als Pluripotenz bezeichnet. Zum anderen müssen sie sich selbst erneuern, um lebenslang Nachschub an spezialisierten Gewebezellen liefern zu können. Am besten untersucht sind diese Vorgänge bei den Blutstammzellen im Knochenmark der Maus.
Wissenschaftler gingen bislang davon aus, dass adulte Stammzellen eine geringe Teilungsrate haben. Damit, so die Theorie, schützen sie ihr Erbgut vor Mutationen, die sich besonders im Verlauf einer Zellteilung ereignen und zur Entartung in eine Tumorstammzelle führen können. Doch über die tatsächliche Anzahl der Teilungen einer Blutstammzelle während der Lebensspanne des Organismus herrschte Unklarheit.
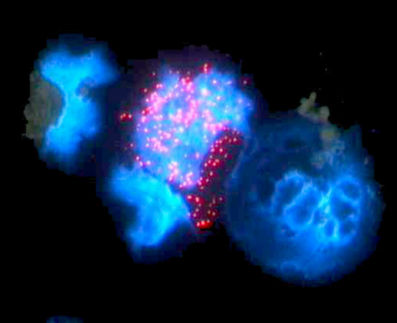
Professor Dr. Andreas Trumpp und Dr. Anne Wilson entdeckten nun im Knochenmark der Maus eine Gruppe von Stammzellen, die fast lebenslänglich in einer Art Schlafzustand verharrt. Trumpp, der seit Sommer 2008 die Abteilung Zellbiologie im Deutschen Krebsforschungszentrum leitet, führte diese Untersuchungen an der Ecole Polytechnique Fédérale in Lausanne durch, gemeinsam mit Kollegen im ebenfalls dort ansässigen Ludwig Institute for Cancer Research.
Die Wissenschaftler markierten das Erbgut aller Blutzellen der Maus und untersuchten anschließend, wie lange diese Markierung in Stammzellen erhalten bleibt: Bei jeder Teilung wird das Erbgut auf die Tochterzellen verteilt, und die Markierung dünnt daher aus. Dabei entdeckten sie die schlafenden Stammzellen, die sich während des gesamten Lebens der Maus nur etwa fünfmal teilen. Auf den Menschen übertragen, entspräche dies nur einer Zellteilung innerhalb von 18 Jahren. Die längste Zeit über verharren diese Zellen, die nur etwa 15 Prozent der gesamten Stammzellpopulation ausmachen, in einer Art Schlafzustand mit sehr niedrigem Stoffwechsel. Dagegen teilen sich die Stammzellen der größeren Gruppe, die „aktiven“ Stammzellen, kontinuierlich etwa jeden Monat.
Tritt jedoch eine Notfall-Situation ein, wie etwa eine Verletzung des Knochenmarks, oder wird der Botenstoff G-CSF ausgeschüttet, so erwacht die schlafende Zellpopulation. Einmal geweckt, zeigt sie das höchste Potenzial zur Selbsterneuerung, das bisher bei Stammzellen beobachtet wurde. Werden sie in bestrahlte Mäuse transplantiert, so ersetzen sie deren zerstörtes Knochenmark und stellen das gesamte blutbildende System wieder her. Aus den transplantierten Tieren können erneut schlafende Stammzellen isoliert werden, die in der Lage sind, Knochenmark zu ersetzen – dies gelingt mehrfach in Serie. Anders die Situation bei den aktiven Stammzellen – hier gelingt der Knochenmarks-Ersatz nur ein einziges Mal.
„Wir gehen davon aus, dass die schlafenden Stammzellen im gesunden Organismus kaum eine Rolle spielen“, erläutert Andreas Trumpp. „Der Körper behält seine „potentesten“ Stammzellen als stille Reserve für Notfallsituationen und versteckt sie im Knochenmark in Höhlen, auch Nischen genannt. Wird das Knochenmark geschädigt, so beginnen sie sofort, sich täglich zu teilen, weil schnell neue Blutzellen benötigt werden.“ Sobald die ursprüngliche Zellmenge wieder hergestellt und das Knochenmark repariert ist, fallen diese Stammzellen erneut in den Tiefschlaf. Die größere Population der „aktiven“ Stammzellen dagegen erhält das physiologische Gleichgewicht der Blutzellen im gesunden Normalzustand aufrecht.
Andreas Trumpp geht davon aus, dass diese Ergebnisse wichtige Impulse für das Verständnis der Krebsstammzellen geben können: „Auch Krebsstammzellen verharren vermutlich die meiste Zeit über in einem Schlafzustand – wahrscheinlich ist dies einer der Gründe, warum sie resistent gegen viele Chemotherapien sind, die auf schnell wachsende Zellen abzielen. Könnten wir diese Schläfer wecken, bevor der Patient behandelt wird, wäre es eventuell möglich, erstmals auch Krebsstammzellen zu eliminieren und damit die Erkrankung viel effektiver zu behandeln, da die Nachschubbasis zerstört wird.“
In einer weiteren Arbeit zeigt Dr. Elisa Laurenti aus Andreas Trumpps Team, dass die beiden Krebsgene c-Myc und N-Myc für die Funktion der Stammzellen unerlässlich sind. Die beiden Gene liefern die Bauanleitung für so genannte Transkriptionsfaktoren, die ihrerseits die Aktivität anderer Gene regulieren und vor allem in Krebszellen überaktiv sind. Werden in Mäusen c-Myc und N-Myc zugleich ausgeschaltet, so leiden die Tiere schnell unter einem generellen Mangel an Blutzellen, an dem sie nach kurzer Zeit bereits versterben.
Die beiden Gene sind nicht nur für das Überleben fast aller Blutzellen verantwortlich, sondern kontrollieren außerdem gemeinsam die beiden wichtigsten Eigenschaften der Stammzellen – die Fähigkeit zur Selbsterneuerung sowie das Potenzial, differenzierte Blutzellen zu produzieren. Dieses Ergebnis ist nicht nur wichtig für das Verständnis der Stammzellen, sondern erklärt auch, welchen Schaden überaktive Myc-Gene anrichten können, erläutert Andreas Trumpp: „Auch in Tumoren sind c-Myc und N-Myc vermutlich für die Selbsterneuerung der Krebsstammzellen und damit für das unkontrollierte Wachstum verantwortlich.“
Originalveröffentlichungen: Anne Wilson et al.; "Hematopoietic stem cells reversibly switch from dormancy to self-renewal during homeostasis and repair"; CELL 2008
Elisa Laurenti et al.; "Hematopoietic Stem Cell Function and Survival Depend on c-Myc and N-Myc Activity"; CELL Stem Cell 2008