Kleben auf Lücke
Klebende Muschelproteine haften weitgehend unabhängig davon, wie viele bindende Bestandteile sie enthalten - damit werden neuartige Klebstoffe möglich
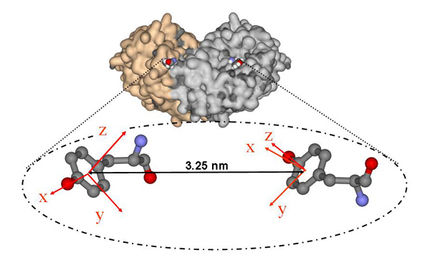
Rau geht es im Leben vieler Muscheln zu: Wenn sie nahe der Küste auf dem Meeresgrund siedeln, zerrt das ständige Vor- und Zurück der Meeresbrandung an ihnen. Um von den Wogen nicht weggespült zu werden, heften sie sich mithilfe spezieller Proteine am Untergrund fest. Damit können sie etwas, womit Ingenieure noch Schwierigkeiten haben: unter Wasser kleben. Das verdanken die Schalentiere der Aminosäure Dihydroxyphenylalanin, kurz Dopa. Sie kann dank ihres chemischen Aufbaus sehr stabile Verbindungen zu Metallen und Mineralien knüpfen und ist in den Adhäsionsproteinen enthalten, mit denen sich die Muscheln am Boden festkleben.

So lässt sich kleben:Manche Muscheln heften sich mit Proteinen an den Untergrund, die mit einem geringen Anteil der bindenden Aminosäure Dopa genauso gut haften wie mit einem hohen.
Creative Commons / Andreas Trepte, Marburg
Die klebenden Muschelproteine haben Wissenschaftler um Hans-Jürgen Butt, Direktor am Max-Planck-Institut für Polymerforschung und Wolfgang Tremel, Professor an der Universität Mainz, mit künstlichen Polymeren nachgeahmt. Diese bestehen aus langen Molekülketten und tragen die gleichen chemischen Anhängsel, die auch die Muschelproteine haftbar machen. Wie viele der Kettenglieder die bindenden Anhängsel von Dopa tragen spielt dabei für die klebende Wirkung der Kette insgesamt keine Rolle - solange es nicht weniger als ein Zehntel der Glieder sind. Das haben die Mainzer Forscher nun festgestellt.
Die Forscher haben gemessen, mit welcher Kraft sie verschiedene Polymerketten von einer Oberfläche lösen konnten. Dabei testeten sie Polymere, die gänzlich, zu einem Fünftel oder einem Zehntel aus den Gliedern mit dem bindenden Anhängsel von Dopa bestanden. Die Kraft, um ein einzelnes Polymer von der Oberfläche abzuziehen, war stets dieselbe, nämlich 67 Pikonewton. Das entspricht ungefähr dem Millionsten Teil der Gewichtskraft eines Flohs. Diese Kraft alleine könnte keine Muschel am Meeresgrund halten. Die Schalentiere kleben sich aber mit einem Klecks unzähliger Polymerketten am Boden fest und können so der Brandung trotzen.
"Dass die klebende Wirkung der Proteine bis zu einem gewissen Grad unabhängig von der Zahl der Bindungsstellen ist, ließe sich ausnutzen, um den übrigen Gliedern des Polymers andere Funktionen zu geben", sagt Hans-Jürgen Butt. Chemiker könnten etwa ein Polymer herstellen, das auf verschiedenen Materialien gleich gut haftet. Dopa verbindet sich vor allem mit Metallen und Mineralien. Andere Glieder der Polymerkette könnten Chemiker mit Anhängseln versehen, die auf Holz, Glas oder Knochen haften. "Kleber, die Metall und Knochen verbinden, wären etwa interessant um künstliche Gelenke zu befestigen", sagt Wolfgang Tremel.
Warum die Haftkraft der Polymerkette weitgehend unabhängig von der Zahl der bindenden Glieder ist, war den Mainzer Forschern erst einmal rätselhaft. "Gewöhnlich stellen wir uns ein klebendes Polymer wie einen Streifen Tesafilm vor, der über seine ganze Länge haftet", sagt Hans-Jürgen Butt. Ein Klebestreifen lässt sich jedoch umso schwerer abziehen, je mehr Bindungen ihn am Untergrund festhalten. Für die Muschelproteine und ihre künstlichen Pendants taugt dieses Modell also nicht, das die Klebewirkung eines Polymers als kontinuierliche Kraft beschreibt.
"Wir betrachten unsere Polymere als Ketten einzelner Bindungsstellen, verbunden von sehr weichen Federn", sagt Wolfgang Tremel. Beim Abziehen messen er und seine Mitarbeiter daher nur die Kraft, mit der eine einzelne Bindungsstelle am Untergrund verankert ist. Wie dicht die klebenden Ketteglieder aufeinander folgen ist dann unerheblich.
Die Dichte der Bindungsstellen würde sich auswirken, wenn ein Gewicht auf ganzer Länge gleichmäßig an dem Polymer zieht und nicht von einem Ende her. "In der Praxis spielt das nur eine Rolle, wenn der Untergrund absolut eben ist", erklärt Butt: "Die meisten Oberflächen sind auf der Nanoskala aber sehr rau, sodass ein Gewicht an einem Ende immer stärker an ihm zieht als am anderen."
Entsprechend dieses Ablöseprozesses gestalten die Wissenschaftler ihr Experiment: Sie tragen eine einzelne Schicht des Polymers auf eine Titanoberfläche. Mit der nur wenige Nanometer messenden Titanspitze eines Rasterkraftmikroskops nehmen sie nun eine einzelne Kette des Polymers auf, so wie man einen Faden mit einem Finger von einem Tisch hebt. Anschließend ziehen sie die Spitze von der Oberfläche weg und messen die dafür erforderliche Kraft. 67 Pikonewton benötigen sie demnach, um die Bindung zwischen der Titanoberfläche und einer Dopa Gruppe am Polymer zu brechen. Da das Polymer sich selbst wie eine weiche Feder verhält, fällt die Kraft bis zum nächsten Bindungsbruch kaum ab, sondern bleibt nahezu konstant.
Die Erkenntnisse aus diesen Experimenten wollen die Mainzer Forscher nun nutzen, um Polymere mit Bindungsstellen für verschiedene Materialien herzustellen.
Originalveröffentlichung: Jijun Wang et al.; "Influence of Binding-Site Density in Wet Bioadhesion"; Advanced Materials, Oktober 2008