Bayreuther Forschung zum Verständnis der Bindung gasförmiger Substrate an komplexe biologische Metallzentren
Die biologischen Umsetzungen gasförmiger Substrate, wie Stickstoff, Wasserstoff, Kohlendioxid (CO2), Kohlenmonoxid (CO) und Methan, sind von zentraler Bedeutung für die biogeochemischen Stoffkreisläufe der Erde. Katalysiert werden diese Reaktionen zumeist von Enzymen mit komplexen Eisen- und Schwefel-haltigen Metallzentren, die mit weiteren Übergangsmetallen, wie Nickel und Molybdän, vergesellschaftet sein können. Diese Enzyme sind eine Synthese eines sulfidischen Minerals mit einem Polypeptid. Wie die komplexen biologischen Metallzentren ihre gasförmigen Substrate binden und aktivieren, ist noch weitgehend unbekannt, da Komplexe der Metalloenzyme mit ihren Substraten meist instabil sind.
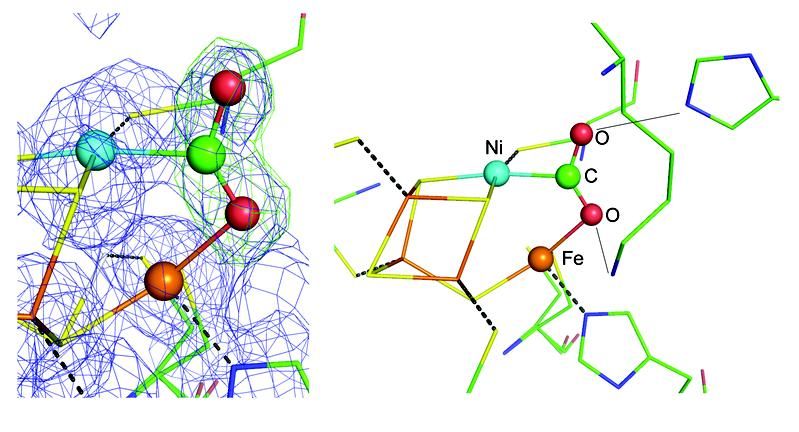
Kohlendioxid gebunden am Ni,Fe-Zentrum der anaeroben Kohlenmonoxid-Dehydrogenase. Links Modell mit Elektronendichte, rechts das Strukturmodell.
UBT-Pressestelle
Die Bayreuther Biochemiker Jae-Hun Jeoung und Holger Dobbek berichten über die Struktur des Enzyms Kohlenmonoxid-Dehydrogenase im Komplex mit CO2. Die Kristallstruktur zeigt wie CO2 durch die Bindung an ein Nickel- und ein Eisen-Ion des Enzyms aktiviert wird. Zwei weitere Strukturen der Kohlenmonoxid-Dehydrogenase identifizieren die Bindestelle des Kosubstrates Wasser am Ni, Fe-Zentrum. Im Kontext mit spektroskopischen Untersuchungen ist es nun möglich einen detailierten Katalysemechanismus der enzymatischen CO-Oxidation / CO2-Reduktion (CO + H2O <=> CO2 + 2H+ + 2e-) zu formulieren.
Originalveröffentlichung: Jae-Hun Jeoung, Holger Dobbek; "Carbon Dioxide Activation at the Ni,Fe-Cluster of Anaerobic Carbon Monoxide Dehydrogenase"; Science 2007, (318) 1461-1464.
Meistgelesene News
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.