Wissenschaftler klären Struktur und Funktion von molekulargenetischem Schalter im menschlichen Erbgut
Albert Jeltsch, Jacobs-Professor für Biochemie, gelang es erstmals, zusammen mit Prof. Xiaodong Cheng, Experte für Strukturbiologie an der Emory University, USA, die dreidimensionale Struktur eines menschlichen Enzyms zur Genregulierung und dessen Arbeitsweise in der Zelle mittels funktioneller Studien aufzuklären.
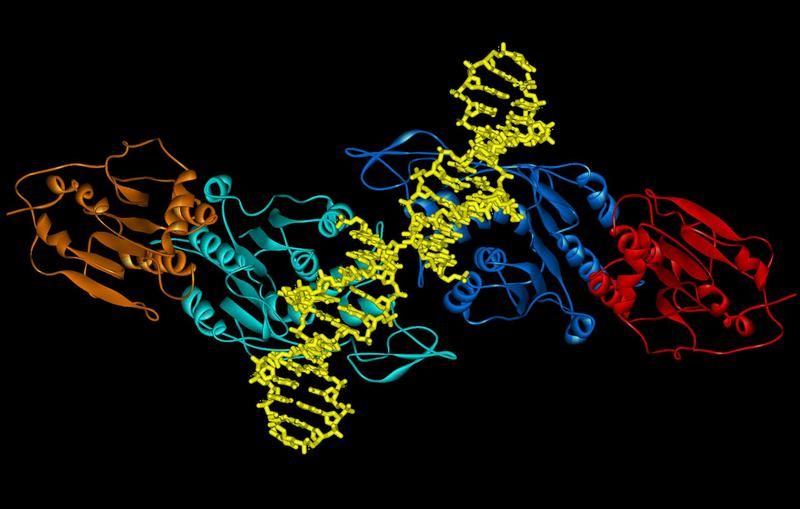
"Doppelpack"-Methyltransferase im Komplex mit DNA (gelb): Die zwei aktiven Zentren des Enzyms in den beiden Dnmt3a-Untereinheiten (cyan bzw. blau) sind auf der DNA im Abstand von ca. 10 Basenpaaren positioniert (orange bzw. rot: regulatorische Untereinheit Dnmt3L).
Jacobs University (International University Bremen)
Bei der Genregulation kommt speziellen Proteinen, den DNA-Methyltransferasen, eine besondere Bedeutung zu. Sie können Sequenzen von Genen im Erbgut erkennen und durch so genannte DNA-Methylierung, die Anlagerung von Methylgruppen als Markermolekülen an Schlüsselpositionen, das Ablesen der nachfolgenden Gensequenz und somit ihre Aktivierung verhindern. Störungen dieses Prozesses können zu Entwicklungsdefekten führen und Krankheiten auslösen.
Die Forscher um Albert Jeltsch und Xiaodong Cheng klärten jetzt mittels Röntgenkristallographie die räumliche Struktur der menschlichen Proteine Dnmt3a und Dnmt3L, die als Funktionseinheit eine zentrale Rolle bei der Genregulierung durch DNA-Methylierung während der menschlichen Embryonalentwicklung spielen. Das überraschende Ergebnis der Strukturanalyse war, dass sich jeweils zwei Dnmt3a-Dnmt3L-Einheiten als Dimer aneinanderlagern, so dass eine Methyltransferase mit zwei aktiven Zentren in einem ganz bestimmten räumlichen Abstand entsteht. Funktionelle Untersuchungen zur Bindung des Enzyms an die Ziel-DNA-Sequenz im menschlichen Erbgut zeigten, dass der spezifische räumliche Abstand der beiden aktiven Zentren des Enzyms in der Art eines Schlüssel-Schloss-Prinzips häufig auch auf der Ziel-Sequenz der DNA zu finden war. Methylierungsexperimente konnten darüber hinaus zeigen, dass beide Zentren auch oft gleichzeitig für einen Anlagerung von Methylgruppen an die DNA sorgten.
"Die besondere Struktur und Funktionsweise des von uns untersuchten Enzyms zeigt ganz neue Facetten der Methylierung von DNA in menschlichen Zellen. So könnte das neu entdeckte enzymatische 'Doppelpack' zum einen eine spezielle Form von Bindungsspezifität zwischen Enzym und Zielmolekül darstellen. Die parallele Aktivität der beiden Zentren könnte auch dafür sprechen, dass bestimmte Regulierungsprozesse besonders schnell ausgeführt werden müssen", sagte Albert Jeltsch zu den Ergebnissen der Studie. "In jedem Fall bringt uns unser Forschungsergebnis dem Verständnis des faszinierenden Vorgangs der organismischen Entwicklung näher, bei dem aus einer befruchteten Eizelle ein komplettes Lebewesen entsteht", so der Jacobs-Wissenschaftler abschließend.
Meistgelesene News
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.





















































