Forscher aus Heidelberg und Zürich mit neuen Einblicken in die Synthese von Vitamin B6
Seit den 40-er Jahren, als Vitamin B6 entdeckt wurde, weiß man um seine Bedeutung. In der Tat nimmt man an, dass dieses Vitamin an mehr Stoffwechselvorgängen als jeder andere Nährstoff beteiligt ist. Fehlt Vitamin B6 in der Nahrung des Menschen, kommt es zu weit reichenden Störungen. In seiner Komplexität ist Vitamin B6 letztlich notwendig, damit Immun- und Nervensystem richtig funktionieren, es ist also für die körperliche und geistige Gesundheit essentiell. Die täglich notwendige Zufuhr von etwa 1.5 mg wird beim Menschen üblicherweise durch die Nahrung gedeckt.
Eine Forschergruppe des Biochemiezentrums der Universität Heidelberg hat nun aufgeklärt, wie die molekulare Maschinerie aussieht, mit der Bakterien Pyridoxal 5'-phosphat (PLP) synthetisieren. Bei diesem Stoff handelt es sich um die biologisch aktive Form von Vitamin B6. Das Forschungsvorhaben wurde in enger Kooperation mit der ETH Zürich durchgeführt und ist aus einem internationalen von der EU geförderten Konsortium zur Erforschung der Vitamin B6-Biosynthese des Malaria Erregers Plasmodium falciparum entstanden. Hierbei geht es darum, therapeutische Ansätze gegen die Malaria zu entwickeln.
Eine Vielzahl von Organismen kann Vitamin B6 synthetisieren, darunter auch viele Bakterien, Pflanzen, und eben die Erreger der Malaria. Der allgemeine Syntheseweg ist eine relativ neue Entdeckung, die unter anderem von der Züricher Arbeitsgruppe beschrieben wurde. Man nahm lange Zeit an, dass die PLP-Synthese bei allen Organismen so funktioniert, wie sie für das Darmbakterium E. coli, dem Modellorganismus der Mikrobiologen, beschrieben wurde. Die neuen Daten zeigen nun, dass die Mehrzahl der Organismen eine völlig andere biosynthetische Route für die PLP-Synthese verwendet. Ausgehend von einem Fünffach- und einem Dreifachzucker wird unter Verwendung von Glutamin als Stickstoffquelle PLP direkt durch einen Enzymkomplex synthetisiert, dessen Struktur nun aufgeklärt ist.
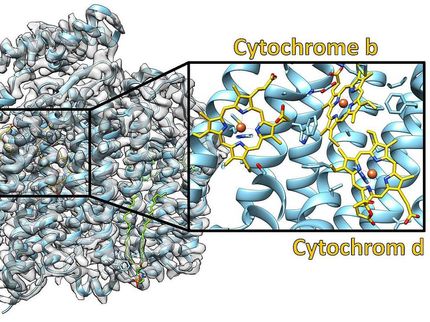
Für ihre Studien benutzen die Forscher die Technik der Röntgenkristallographie, bei der ein atomares Modell des Enzyms erhalten wird. Es zeigt sich, dass ein riesiger Multienzymkomplex notwendig ist, um PLP zu synthetisieren. Dabei lagern sich insgesamt 24 Proteine zusammen. Zwölf PLP-Synthase-Untereinheiten bilden einen Doppelring aus je sechs Untereinheiten. Zwölf weitere enzymatische Untereinheiten binden an die PLP-Synthase und versorgen diese mit Ammonium, das aus der Aminosäure Glutamin gewonnen wird. So entstehen insgesamt zwölf unabhängige Doppel-Enzyme, die PLP synthetisieren können. Kenntnis des molekularen Aufbaus ist ein wesentlicher Schritt zum Verständnis der Vitamin B6-Biosynthese.
Originalveröffentlichung: Marco Strohmeier, Thomas Raschle, Jacek Mazurkiewicz, Karsten Rippe, Irmgard Sinning, Teresa B. Fitzpatrick, Ivo Tews; "Structure of a bacterial pyridoxal 5?-phosphate synthase complex", Proceedings of the National Academy of Sciences 2006.
Meistgelesene News
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.