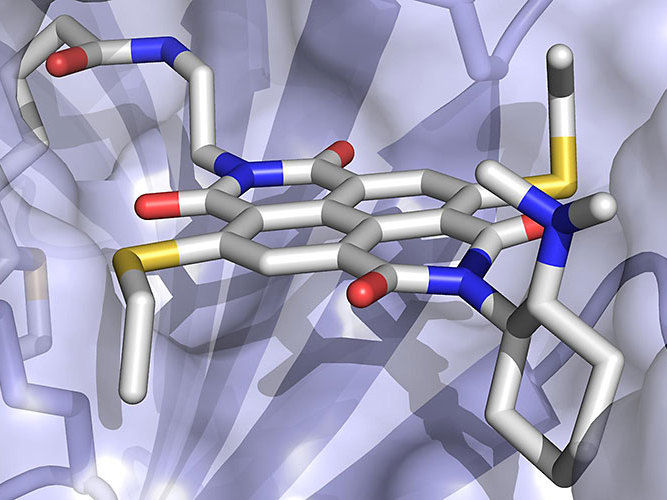
Einem Peptid bei der Arbeit zugesehen
2D-Spektroskopie ermöglicht "Filmaufnahmen"
Proteine ihre Struktur und somit ihre Funktion binnen Pikosekunden zu verändern. Mit der zweidimensionalen Infrarotspektroskopie ist es einem Team aus Züricher und Bochumer Forschern (Prof. Dr. Wolfram Sander, RUB, Prof. Dr. Peter Hamm, Uni Zürich) erstmals gelungen, diese sehr schnellen Bewegungen von Peptiden - kurzen Proteinstücken - zu filmen. Die Methode erlaubt es zu bestimmen, ob zwei molekulare Gruppen im Peptid zu einem bestimmten Zeitpunkt benachbart sind oder nicht und eignet sich daher für die experimentelle Überprüfung von theoretischen Modellen.
Proteine ändern fortwährend ihre Struktur, binden an andere Stoffe und transportieren diese zu ihrem Bestimmungsort, oder sie steigern die Effizienz bestimmter chemischer Reaktionen. Gäbe es ein Mikroskop, mit dem man ein Protein sichtbar machen könnte, so würde man feststellen, dass einzelne Atome oder Molekülgruppen innerhalb des Proteins sich auf einer unvorstellbar kurzen Zeitskala von wenigen Pikosekunden bewegen. Man glaubt, sehr viel über diese schnelle Dynamik aus theoretischen Berechnungen zu wissen - deren experimentelle Beobachtung und Verifizierung erweist sich jedoch als extrem schwierig.
Den Forschern ist es nun gelungen, die superschnelle Veränderung eines kleinen Peptids sichtbar zu machen; sie "filmten" buchstäblich das Peptid, während es sich von einer Struktur in eine andere umwandelte. Verwendung fand hierbei eine neuartige spektroskopische Methode, die so genannte zweidimensionale Infrarotspektroskopie. Diese ermöglicht es zu bestimmen, ob zwei molekulare Gruppen im Peptid zu einem bestimmten Zeitpunkt räumlich benachbart sind oder nicht. "Diese Technik eröffnet ein neues, bisher unzugängliches Zeitfenster für die Beobachtung der Strukturdynamik von Biomolekülen und erlaubt deshalb eine sehr direkte experimentelle Verifizierung theoretischer Modelle", erläutert Prof. Sander.
Originalveröffentlichung: Christoph Kolano, Jan Helbing, Mariusz Kozinski, Wolfram Sander, Peter Hamm; "Watching hydrogen-bond dynamics in a beta-turn by transient two-dimensional infrared spectroscopy". Nature 2006, Vol 444 (7118), pp.469-472.
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!