Orphan Medicinal Product Designation in Europa für vasopharms VAS203
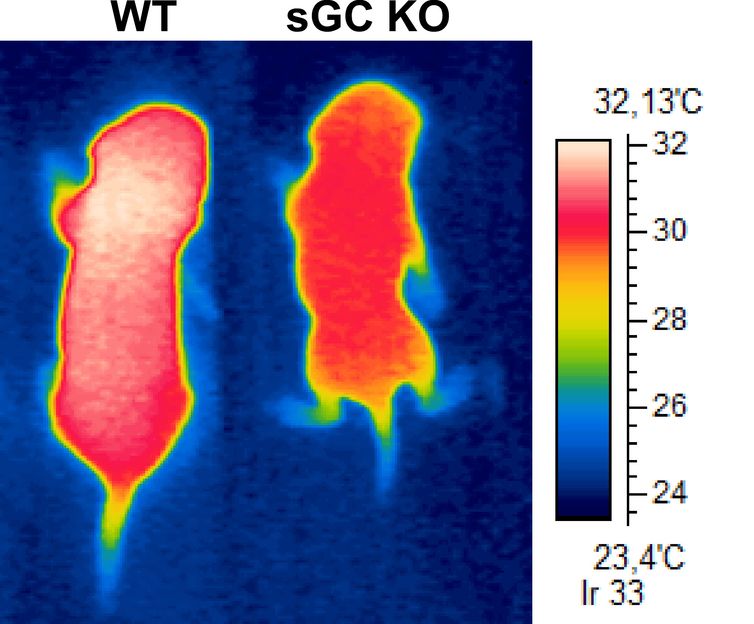
Die vasopharm GmbH hat die Orphan Medicinal Product Designation (OMPD) für ihren Produktkandidaten VAS203 durch die Europäische Kommission nach positiver Prüfung der European Medicines Agency (EMEA) erhalten. VAS 203, ein Stickoxid Synthase (NOS) Modulator, wurde gezielt zur Behandlung der Akutindikation des geschlossenen Hirntraumas entwickelt.
vasopharm profitiert insbesondere durch ein 10-jähriges exklusives Vermarktungsrecht sowie einer Beschleunigung der Zulassungsbearbeitung und Gebührenermäßigungen im zentralisierten Zulassungsverfahren. Darüber hinaus gewährleistet die EMEA wissenschaftliche Beratung in Form einer "protocol assistance". Außerdem besteht nunmehr die Möglichkeit für die Gesellschaft an spezifischen EU Fördermaßnahmen zu partizipieren.
Durch den OMP Status wird die Weiterentwicklung von VAS203 laut Unternehmen beschleunigt und die Entwicklungskosten reduziert werden können. Im vierten Quartal 2006 plant vasopharm den Beginn der Klinischen Phase I. Parallel dazu unterstützt das European Brain Injury Consortium (EBIC) die Gesellschaft bei den Vorbereitungen zu Durchführung der Klinischen Phase IIa.
Meistgelesene News
Weitere News aus dem Ressort Forschung & Entwicklung

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
BioPartners Cologne - Köln, Deutschland
Biotech-Unternehmen will bei Börsengang 64 Millionen Euro einnehmen

Verunreinigungen in Tees und Honig sind die Hauptaufnahmequellen für Pyrrolizidinalkaloide - BfR bewertet Gesundheitsrisiko durch PA in wichtigen Lebensmittelgruppen

ProMetic Life Sciences Inc. - Mount-Royal, QC, Kanada
Kategorie:Gelenk
Studie: Medizintechnik vor einem Boom