Kleiner Unterschied, große Wirkung: Was führt zu Autoimmunität?
Zahlreiche Erkrankungen, vor allem aus dem rheumatischen Formenkreis, gelten als Autoimmunkrankheiten, die darauf beruhen, daß das Immunsystem der Patienten körpereigene Strukturen angreift. Das Wesen dieser Autoaggression wird indessen bisher nicht verstanden. In Kooperation mit Kristallographen der Freien Universität Berlin (Arbeitsgruppe Prof. Wolfram Saenger) und Immunologinnen der Universität Rom "La Sapienza" (Arbeitsgruppe Prof. Rosa Sorrentino) ist jetzt der Arbeitsgruppe um Frau Dr. Barbara Uchanska-Ziegler am "Institut für Immungenetik" der Charité ein Schritt zur Aufklärung gelungen. Die Forscher befassen sich mit einer rheumatischen Erkrankung (Morbus Bechterew), bei der es bei den betroffenen Patienten (ca. 200 000 allein in Deutschland) u.a. zur Versteifung der Wirbelsäule kommen kann.
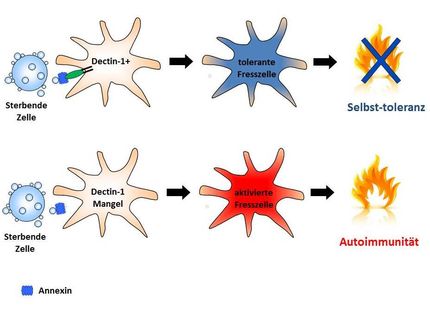
Das Immunsystem ist normalerweise dazu da, in den Körper eingedrungene Keime oder andere als fremd empfundene Substanzen zu erkennen und unschädlich zu machen. Jede Körperzelle kann, sobald fremdes Eiweiß (Virus, Bakterium) in sie eindringt, dies dem körpereigenen Immunsystem anzeigen. Dazu zerlegt sie das Fremdeiweiß in Teilstücke, sog. Peptide, und bindet diese an spezielle Zellstrukturen (HLA-Moleküle). Die Bindung gelingt, indem die Peptide sich dabei in einer Furche, die das HLA-Molekül bildet, an dort vorhandenen Andockstellen gewissermaßen festkrallen. Das HLA-Molekül hat dann die Aufgabe, das gebundene Peptid an die Zelloberfläche zu transportieren und es dort den vorbeiströmenden Immunzellen (T-Zellen) wie eine Flagge zu präsentieren. Wenn T-Zellen das Peptid als körperfremd erkennen, kommt es zu einer Kaskade von Reaktionen, welche die Vernichtung der "erkrankten" Zelle zum Ziel hat. Erscheint den T-Zellen das Peptid indessen als körpereigen, so bleibt der T-Zell-Kontakt ohne Folgen.
Die Unterscheidung zwischen "fremd" und "eigen" kann für Immunzellen allerdings schwierig werden, da sie sich auch "irren" können: Ein Beispiel dafür fanden die Berliner Forscher: Menschen unterscheiden sich genetisch in Bezug auf ihre HLA-Moleküle, die in einer großen Vielfalt vorkommen und dadurch eine große Anzahl verschiedener Peptide binden können. Die Forscher untersuchten die HLA-Moleküle von Personen, die das Gen HLA-B27 besitzen und damit ein stark erhöhtes Risiko aufweisen, an Morbus Bechterew zu erkranken. Gefährdet ist allerdings nicht jeder HLA-B27-Träger. Das Risiko hängt vielmehr auch von Untergruppen von HLA-B27 ab. So ist mit der Variante B*2709 keine Gefahr verbunden zu erkranken, wohl aber mit der Variante B*2705.
Die Forscher haben erkannt, daß der Unterschied zwischen den beiden Varianten in nur einer einzigen Aminosäure im HLA-Molekül und zwar genau in der Bindungsfurche besteht. Dadurch wird ein körpereigenes Peptid unterschiedlich an das HLA Molekül gebunden:
Bei Menschen mit der Variante B*2709 geschieht dies in bereits bekannter, konventioneller Weise und die T-Zellen reagieren darauf nicht. Der Mensch bleibt gesund.
Bei Trägern der B*2705-Variante sorgt deren spezielle Aminosäure dafür, daß hier das selbe körpereigene Peptid in völlig neuartiger Weise gebunden wird und damit in einer Konformation vorliegt, die von T-Zellen als fremd eingestuft und attackiert wird. Die Autoaggression hängt also von einer einzigen Aminosäure ab. Die neu gefundene Peptid-Konformation konnten die Wissenschaftler in atomarem Detail anschaulich machen und ihre Erkenntnisse kürzlich im angesehenen Fachblatt "Journal of Experimental Medicine" (Martin Hülsmeyer et al., 199:271-281 [2004]) veröffentlichen.
Die Wissenschaftler glauben (und haben auch erste Hinweise darauf), daß die besondere Konformation (aus körpereigenm Peptid und HLA-B*2705) einem fremden, von Viren stammenden Peptid so stark ähnelt, daß T-Zellen keine Unterscheidung mehr treffen können und auch das körpereigene Peptid angreifen. Diese "molekulare Mimikry" könnte das bisher fehlende Verbindungsglied zu autoaggressiven Krankheitsbildern wie dem Morbus Bechterew sein.
Meistgelesene News
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.