Ferngesteuerte Nervenzellen: Geheimnis des "Lichtschalters" gelüftet
Nervenzellen per Schalter gezielt an- und auszuknipsen – das ermöglicht die Optogenetik mit speziellen lichtempfindlichen "Protein-Schaltern". Eines der wichtigsten davon ist Channelrhodopsin 2, das erste der "Lichtschalter-Proteine", bei denen der Einbau in Nervenzellen gelang. Heute wird es in Laboratorien weltweit eingesetzt und hat den Startpunkt für das heute in den Neurowissenschaften nicht mehr wegzudenkende Gebiet der Optogenetik gesetzt. Channelrhodopsin 2 wird in der neurowissenschaftlichen Grundlagenforschung aber auch in der Muskelphysiologie sowie in der Zellbiologie mit einer Perspektive für neue gentherapeutische Ansätze eingesetzt. Doch erst jetzt gelang es Wissenschaftlern aus Jülich, Frankfurt, Grenoble und Moskau den Bauplan d.h. die molekulare Struktur dieses lichtempfindlichen Proteins aufzuklären, womit ein Meilenstein zum Verständnis der Funktion gesetzt wurde. Die Ergebnisse wurden in Science veröffentlicht.
Die Optogenetik ermöglicht die Aktivität von Neuronen mit zuvor unerreichbarer Genauigkeit mit Licht zu steuern. Herzstück dieser Forschungsrichtung sind spezielle rhodopsinartige Proteine aus Mikroorganismen. Schleust man sie in die Membran von Nervenzellen ein, fungieren sie dort als Lichtschalter, die zur Aktivierung positive Ionen in die Zelle transportieren. Werden die Ionen durch ein anderes Rhodopsin aus der Zelle heraustransportiert führt dies zur Inaktivierung der Zelle. Auf welche Lichtfarbe die Proteine reagieren und welche Teilchen sie aus der Zelle hinaus oder in sie hinein befördern, ist von Schalter zu Schalter verschieden. Wissenschaftler können Nervenzellen also per Lichtimpuls ferngesteuert gezielt ein- und ausschalten und untersuchen, wie diese funktionieren. Dies eröffnet ihnen ein weites Feld, da sie das Zusammenspiel neuronaler Schaltkreise in Zellkultur aber auch im lebenden Tier viel genauer als bisher untersuchen können. Daraus resultiert die Möglichkeit neurodegenerative Krankheiten mit viel größerer Präzision zu analysieren und mögliche Heilchancen zu entwickeln.
Einer der wichtigsten Schalter ist das Channelrhodopsin 2 aus einer einzelligen Süßwasseralge, das im Jahr 2003 als völlig neuartiger Kationenkanal beschrieben wurde. Bis dato waren jedoch weder die hochaufgelöste Struktur noch die strukturellen Mechanismen des Channelrhodopsin 2 bekannt. "Das Entziffern der Struktur würde jedoch die Lösung dreier wichtiger Fragenkomplexe voranbringen" sagt Professor Ernst Bamberg vom Max-Planck-Institut für Biophysik in Frankfurt "nämlich erstens das fundamentale biophysikalische Problem, wie sieht die hochaufgelöste Struktur aus und welche funktionellen Eigenschaften können aus der Struktur abgelesen werden? Zweitens, was ist der Gewinn für die Anwendung in der Optogenetik? Und drittens, welche Schlüsse können für eventuelle gentherapeutische Ansätze gezogen werden?" Bei Letzterem geht es um die Optimierung oder Neukonstruktion der optogenetischen Werkzeuge zur Erforschung neurodegenerativer und muskulärer Krankheiten wie Altersblindheit, Hörverlust oder lichtstimulierbare Herzschrittmacher zur Synchronisation von Herzmuskeln. "Bei der Altersblindheit sind bereits große Fortschritte gemacht, das heißt erste klinische Versuche werden mit einem gentherapeutischen Ansatz unter Verwendung von Channelrhodopsin 2 mit bereits ersten Erfolgen durchgeführt." So Bamberg.
Der Jülicher Strukturbiologe Professor Valentin Gordeliy und seine Mitarbeiter vom Institut für Strukturbiochemie (ICS-6) sowie Forscher im französischen Grenoble, in Moskau und Frankfurt sind bei der Beantwortung dieser Fragen ein großes Stück weitergekommen: "Wir konnten die Struktur von Channelrhodopsin bestimmen – und haben damit die molekulare Basis gelegt, um die Funktionsweise des Schalters bis ins Detail zu verstehen", freut sich Gordeliy.
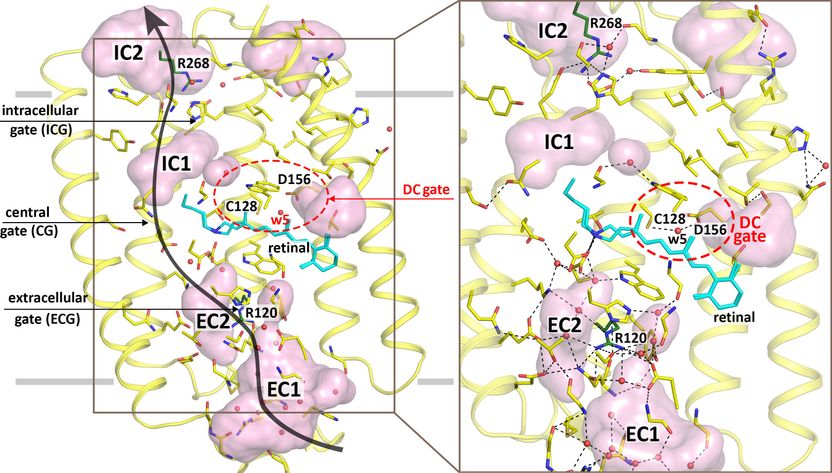
Darstellung der Struktur von ChR2. (A) Vier Hohlräume und drei Toröffnungen formen die Kanalpore. (B) Das Netzwerk mit Wasserstoffbindungen. Das DC-Tor ist als rote Ellipse abgebildet. Schwarze Pfeile und horizontale Linien (hellgrau) zeigen den möglichen Ionendurchgang und die Position der hydrophoben/hydrophilen Grenzflächen.
Copyright: Oleksandr Volkov
Die zentrale Struktur des Channelrhodopsins sind vier Hohlräume, die durch drei flexible Verengungen wie durch Tore getrennt sind. Stark vereinfacht schaltet es folgendermaßen: im Dunkeln sind die Tore geschlossen. Knipsen die Forscher das Licht an, öffnen sich alle drei Tore und Ionen können hindurch strömen. Die Zelle wird aktiviert. Wassermoleküle übernehmen dabei die Torwächterfunktion, sie arbeiten quasi als Pförtner. Dazu bilden sie eine Kette aus Wasserstoffbrücken von Wassermolekül zu Wassermolekül. Trifft blaues Licht auf das Channelrhodopsin, so gibt der Farbstoff des Proteins, das Retinal, der an der Oberseite des Proteins gebunden ist, den Befehl, die Tore zu öffnen. Daraufhin lösen die Wassermoleküle die "Absperrkette", so dass sich die drei Tore öffnen und eine durchgängige Pore entsteht.
"Unsere Ergebnisse sind ein Meilenstein in der Optogenetik", sagt Gordeliy. "Denn damit wird es nun möglich, gezielt neue Kanäle mit anderen Eigenschaften zu konstruieren." Institutsleiter Professor Dieter Willbold: "Dieses Ergebnis ist ein exzellentes Beispiel dafür, wie eng Strukturbiologie und Hirnforschung miteinander verbunden sein können. Neben unserem Schwerpunkt auf neurodegenerativen Krankheiten setzen wir deshalb seit längerem auch auf die Optogenetik als Forschungsthema. Gerade hier zeigt sich die Stärke der Bündelung strukturbiologischer Methoden und Expertisen im Institut zusammen mit der Erforschung neurodegenerativer Prozesse und deren Intervention."
Originalveröffentlichung
Oleksandr Volkov, Kirill Kovalev, Vitaly Polovinkin, Valentin Borshchevskiy, Christian Bamann, Roman Astashkin, Egor Marin, Alexander Popov, Taras Balandin, Dieter Willbold, Georg Büldt, Ernst Bamberg, Valentin Gordeliy; "Structural insights into ion conduction by channelrhodopsin 2"; Science 358, eaan8862 (2017).