Erstmals Proteom des menschlichen Herzens entschlüsselt
Wissenschaftler identifizieren fast 11.000 unterschiedliche Herzproteine
Ein gesundes Herz schlägt ungefähr zwei Milliarden Mal im Leben. Forscher des Max-Planck-Instituts für Biochemie und des Deutschen Herzzentrums München an der Technischen Universität München haben nun erfasst, welche und wie viele Proteine in welchen Zelltypen vorhanden sind. Sie haben den ersten Herzatlas des gesunden menschlichen Herzens erstellt, das sogenannte Herzproteom. Damit lassen sich in Zukunft Unterschiede zwischen kranken und gesunden Herzen aufdecken.
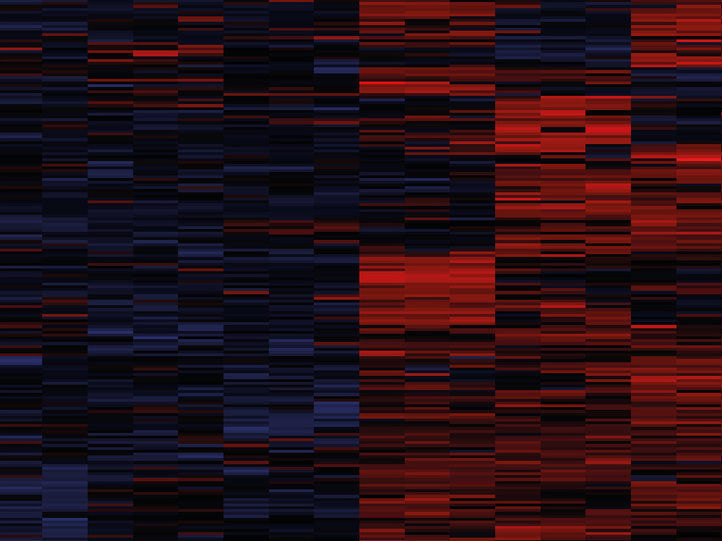
Ausschnitt aus einer sogenannten Heatmap, eine Übersichtsdarstellung analysierter Proteine, die erstmals in einem umfangreichen Herzatlas zusammengefasst wurden.
© MPI für Biochemie/ Doll
Proteine sind die molekularen Maschinen der Zelle und übernehmen dort eine Vielzahl von Funktionen. Diese werden anhand ihrer Bauanleitung, der DNA, hergestellt. Veränderungen auf DNA- oder Protein-Ebene können Krankheiten verursachen. Damit solche Veränderungen als Ursachen für Herzkrankheiten erkannt werden können, ist es wichtig zu wissen, wo welche Proteine im gesunden Herzen vorhanden sind und in welcher Menge sie vorliegen.
Einen solchen Proteinatlas für das Herz hat ein Forscherteam aus München jetzt veröffentlicht. Dafür bestimmten die Wissenschaftler die komplette Proteinausstattung der Zellen in allen Regionen des Herzens wie Herzklappen, Herzkammern und den wichtigsten Blutgefäßen. Insgesamt haben sie im Herz fast 11.000 unterschiedliche Proteine identifiziert. Zudem haben sie die Proteinzusammensetzung in drei unterschiedlichen Zelltypen des Herzens untersucht: den Herzfibroblasten, den glatten Muskelzellen und den Endothelzellen. So konnte das Forscherteam wie auf einer Landkarte die Verteilung der Proteine in den unterschiedlichen Herzbereichen darstellen.
Bisherige Studien konzentrierten sich meist nur auf einzelne Zelltypen oder nutzten Gewebe aus kranken Herzen. „Das bringt zwei Probleme mit sich“, erklärt Sophia Doll vom Max-Planck-Institut für Biochemie und Erstautorin der Studie. „Diese Ergebnisse lieferten kein Gesamtbild des Herzens mit all seinen unterschiedlichen Regionen und Geweben und außerdem fehlten häufig Daten des gesunden Herzens als Vergleich. Unsere Studie hat jetzt beide Probleme gelöst. Die Daten können als Referenz für zukünftige Studien genutzt werden.“
Der Blick in den Proteinatlas unseres Herzens zeigt: Alle gesunden Herzen funktionieren sehr ähnlich. Wir konnten in den einzelnen Regionen jeweils eine ähnliche Proteinzusammensetzung messen, die nur wenige individuelle Unterschiede zeigte. Überraschend war auch, dass sich die rechte und linke Herzhälfte im Atlas gleichen, obwohl sie unterschiedliche Aufgaben übernehmen. Die rechte Hälfte pumpt sauerstoffarmes Blut zur Lunge und die linke das sauerstoffreiche Blut aus der Lunge in den Körper.
Krank oder gesund
Im nächsten Schritt testeten die Forscher, ob sich mit den Daten der gesunden Herzen als Kontrolle auch Veränderungen in kranken Herzen erkennen lassen. Sie verglichen ihre Werte mit Herzproteomen von Patienten mit Vorhofflimmern. Die Ergebnisse lieferten tatsächlich erste Hinweise auf die Ursache der Krankheit: Das Gewebe des kranken Herzens unterscheidet sich am stärksten bei Proteinen, die für die Energieversorgung der Zelle verantwortlich sind.
Der Vergleich ergab noch ein weiteres interessantes Ergebnis: Zwar waren bei allen Patienten die Proteine des Energiestoffwechsels verändert, aber bei jedem gab es individuelle Veränderungen. „Diese Ergebnisse zeigen, wie wichtig die personalisierte Medizin ist. Obwohl alle Patienten sehr ähnliche Symptome haben, ist bei jedem etwas anderes die Ursache. In Zukunft müssen wir gerade in der Herzmedizin lernen, solche individuellen Unterschiede zu erkennen und zu behandeln“, sagt Markus Krane, stellvertretender Direktor der Klinik für Herz- und Gefäßchirurgie am Deutschen Herzzentrum München an der Technischen Universität.
Krane hat zusammen mit seinen Kollegen weit über 150 Gewebeproben aus über 60 Herzoperationen und aus rechtsmedizinischen Proben zusammengetragen und in aufwendigen Zellkulturverfahren die unterschiedlichen Zelltypen daraus gewonnen. Erst diese große Menge an Herzmaterial machte es möglich, die einzelnen Herzbereiche so genau zu untersuchen. Matthias Mann, Direktor am Max-Planck-Institut für Biochemie, führte zusammen mit seinem Team die umfangreichen massenspektrometrischen Messungen durch. Aufgrund der Weiterentwicklung der Massenspektrometrie und der Probenaufarbeitung sind die Wissenschaftler nun auf einem guten Weg zur personalisierten Medizin.