Kristallografie klärt Herstellung von Eisen-Schwefel-Clustern
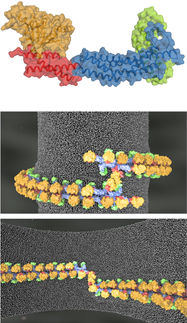
Wissenschaftler aus Marburg und Kanada haben die Struktur eines Proteinkomplexes aufgeklärt, der für die Herstellung lebenswichtiger Enzyme erforderlich ist. Die Forschungsgruppe um den Marburger Biochemiker Professor Dr. Roland Lill von der Philipps-Universität ermittelte, welche dreidimensionale Struktur die sechs Proteine des Komplexes aufweisen, der an der Synthese von Eisen-Schwefel-Clustern beteiligt ist.
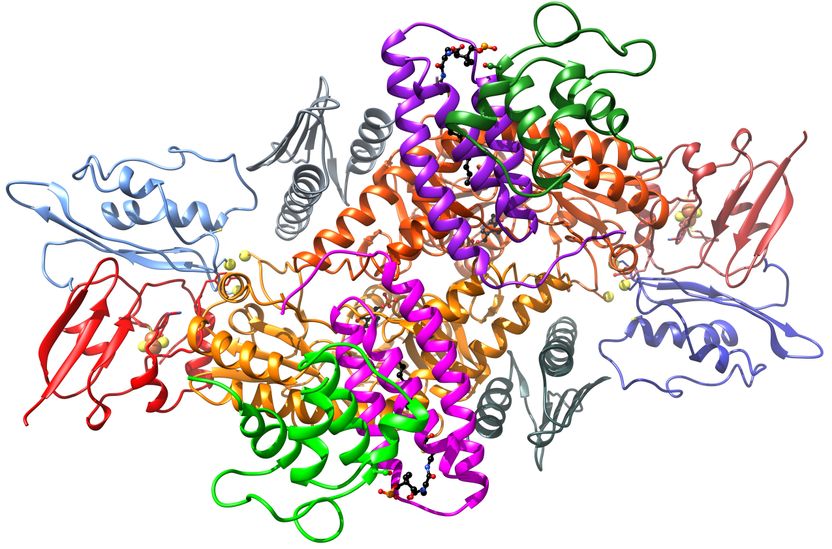
3D-Modell des Proteinkomplexes, der an der Synthese von Eisen-Schwefel-Clustern beteiligt ist.
Dr. Sven-A. Freibert
„Enzyme mit Eisen-Schwefel-Clustern sind unersetzlich für zahlreiche essenzielle Lebensprozesse“, erläutert Lill. Beispiele hierfür sind insbesondere die Energiegewinnung in den Mitochondrien, die Vervielfältigung der Erbsubstanz DNA sowie deren Reparatur nach Schädigungen. „Vor kurzem konnte ein Eisen-Schwefel-Protein charakterisiert werden, das bei der zellulären Virenabwehr hilft“, führt der Marburger Hochschullehrer aus. Ist der Prozess der Synthese von Eisen-Schwefel-Clustern gestört, kommt es zu schwerwiegenden neurologischen Erkrankungen.
Die Entstehung von Eisen-Schwefel-Proteinen ist ein mehrstufiger Prozess, der das Zusammenwirken einiger spezialisierter Enzyme erfordert; er findet in den Mitochondrien statt, die als die Kraftwerke der Zelle gelten. Lill und seine Kollegen präsentieren nun drei Kristallstrukturen, „Schnappschüsse unterschiedlicher Stadien des Syntheseprozesses“, wie Lill erläutert. „Aus diesen Daten konnten wir zum ersten Mal herauslesen, wie die verschiedenen Enzyme des Komplexes räumlich zueinander angeordnet sind und wie sie ihre Funktion koordinieren, um aus Eisen und Schwefel einen Eisen-Schwefel-Cluster zusammenzusetzen.“
Dabei blieben auch Überraschungen nicht aus – so fanden die Forscher heraus, dass zwei kleine Proteine, deren Funktion bisher unbekannt war, eher eine steuernde Funktion übernehmen, als dass sie die Clustersynthese direkt unterstützen: Die Proteine ISD11 und ACP stellen vielmehr sicher, dass die Clustersynthese in enger Abstimmung mit dem Energiehaushalt der Zelle geschieht.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.