Eine stabile Hülle für künstliche Zellen
Wissenschaftler entwickeln zellähnliche Lipidvesikel, die sie mit natürlichen Zellproteinen ausstatten können
Jede Zelle braucht eine Hülle. Eine Membran aus Fettmolekülen trennt das Zellinnere von der Umgebung und schafft dort ein für das Überleben notwendige Milieu. Auch für die Entwicklung künstlicher Zellen ist eine chemisch und mechanisch stabile Hülle eine wesentliche Voraussetzung. Forscher der Max-Planck-Gesellschaft sowie der Universitäten in Heidelberg, Jena, Magdeburg und Bordeaux haben nun im Rahmen des MaxSynBio-Netzwerks mit einer neuen Methode Partikel aus unterschiedlichen Fettsäuren erzeugt, die sich ähnlich wie natürliche Zellmembranen verhalten. Die Wissenschaftler konnten die Vesikel zudem mit natürlichen Zellproteinen befüllen und in die Lipidschicht integrieren. Die Lipidpartikel sind ein wichtiger Schritt hin zur Entwicklung eines Modellsystems, mit dem sich die Abläufe in natürlichen Zellen untersuchen lassen. Sie könnten eines Tages auch ein Bestandteil künstlicher Zellen sein.
Auf den ersten Blick erscheint die Membran natürlicher Zellen als eine vergleichsweise einfach aufgebaute Doppelschicht aus Fettsäuremolekülen. Tatsächlich besitzt die Zellmembran jedoch Eigenschaften, die sich bislang kaum im Labor nachahmen lassen. So besitzen künstliche Zellen zwar eine Hülle aus Fettmolekülen, diese ist jedoch bislang zu instabil und undurchlässig. Wissenschaftler können solche sogenannten Protozellen daher nicht mit Molekülen befüllen, die für Zellvorgänge wichtig sind.
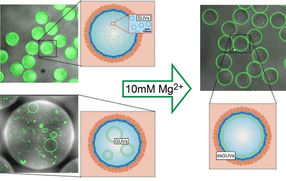
Mit einem Trick haben die Max-Planck-Wissenschaftler zusammen mit ihren Kollegen nun Lipidvesikel erzeugt, die künftig die Hülle für künstliche Zellen bilden könnten. Die Forscher nutzen dafür Tröpfchen aus langkettigen organischen Molekülen, sogenannten amphiphilen Polymeren, die wie Tenside wirken. Die Tröpfchen bestehen aus einer äußeren Schicht sogenannter perfluorierter Polyether und einer innen liegenden Schicht aus wasserlöslichem Polyethylenglykol, an die Gold-Nanopartikel angelagert sind. Dank der unterschiedlichen Löslichkeit der inneren und äußeren Schicht schwimmen die Tröpfchen in einem Öl-haltigem Medium, enthalten im Innern aber eine wässrige Lösung. Mithilfe eines Mikro-Injektionssystems können die Forscher nun winzige Lipidvesikel in die Polymer-Tröpfchen injizieren. Durch die Zugabe von Magnesium lösen sich die Vesikel im Innern auf und verschmelzen zu einer einzigen Lipidschicht an der Innenseite der Tröpfchen.
Automatisierte Produktion
„Die so entstehenden Lipidvesikel sind mechanisch und chemisch so stabil, dass wir Proteine in sie injizieren können, wie sie in natürlichen Zellen vorkommen“, sagt Joachim Spatz vom Max-Planck-Institut für medizinische Forschung in Heidelberg. Mithilfe eines eigens entwickelten Piko-Injektionssystems können die Forscher genau einstellbare Mengen von Zellproteinen in die Polymer-Lipid-Vesikel injizieren. „Wir schaffen damit, pro Sekunde bis zu 1000 Vesikel mit Proteinen zu beladen, zum Beispiel Proteine des Zellskeletts wie Aktin und Tubulin und das Transmembranprotein Integrin. Auf diese Weise erhalten wir innerhalb kurzer Zeit genügend Vesikel für biologische oder medizinische Analysen“, erklärt Spatz. Anschließend entfernen die Wissenschaftler die Tensid-Hülle und überführen die Lipidvesikel in wässrige Lösung. So können diese dann beispielsweise mit Zellen in Kontakt treten.
Die neue Technik befördert nicht nur die Entwicklung künstlicher Zellen, wie sie die Synthetische Biologie und in Deutschland das Forschungsnetzwerk MaxSynBio der Max-Planck-Gesellschaft vorantreibt. Sie stellt auch ein einfacher und schneller produzierbares Modellsystem zur Verfügung, an dem sich die Wechselwirkung mit Signalmolekülen, anderen Zellen oder auch Viren untersuchen lässt.
An dem Projekt waren Forscher der Max-Planck-Institute für medizinische Forschung in Heidelberg, für Dynamik und Selbstorganisation in Göttingen, für Dynamik komplexer technischer Systeme in Magdeburg und für Kolloid- und Grenzflächenforschung in Potsdam sowie der Universitäten in Heidelberg, Jena, Magdeburg und Bordeaux beteiligt.
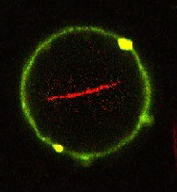
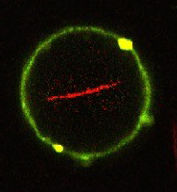
Künstliches Vesikel mit einer Lipidhülle (grün). Injizierte Moleküle des Stützproteins Aktin lagern sich im Innern zu langen Fasern zusammen (rot) und bilden so ähnlich wie in natürlichen Zellen eine Art Stützskelett.
© Weiss et al, Nature Materials 2017
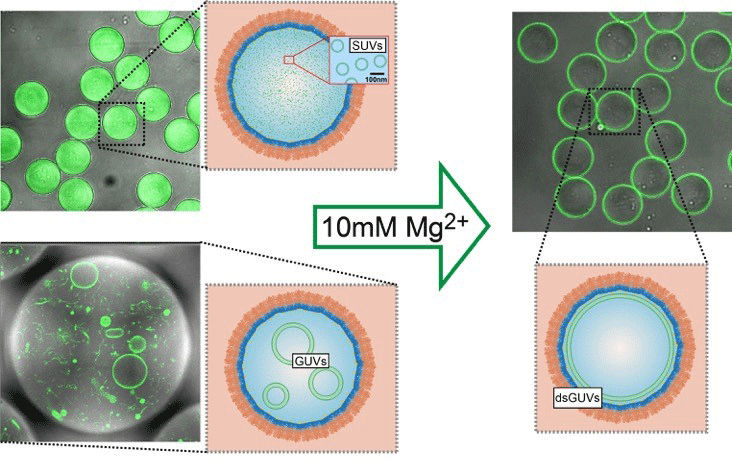
Winzige Lipidvesikel (links: SUVs, GUVs; grün) verschmelzen in einem Polymertröpfchen (orange, dunkelblau) nach der Zugabe von Magnesium zu einer einzigen durchgängigen Lipidschicht an der Innenseite des Tröpfchens (rechts).
© Weiss et al, Nature Materials 2017
Originalveröffentlichung
Marian Weiss et al.; "Sequential bottom-up assembly of mechanically stabilized protocells by microfluidics"; Nature Materials; 17 October, 2017