Algen mit Lichtschalter: Effizienz von Bioreaktoren steigern?
Die Haftung der Härchen von Chlamydomonas-Einzellern hängt von der Lichteinstrahlung ab
Das Licht der Sonne ermöglicht Grünalgen mehr als nur die Photosynthese, mit der sie Zucker aufbauen. Die Einzeller schalten mit Licht sogar die Klebrigkeit der feinen Härchen auf ihrer Oberfläche an und aus, wie jetzt erstmals Physiker am Göttinger Max-Planck-Institut für Dynamik und Selbstorganisation beobachtet haben. Diese Erkenntnisse sind nicht zuletzt für die Entwicklung von Bioreaktoren interessant, in denen Algen als nachwachsender Rohstoff zur Biotreibstoff-Produktion Anwendung finden.
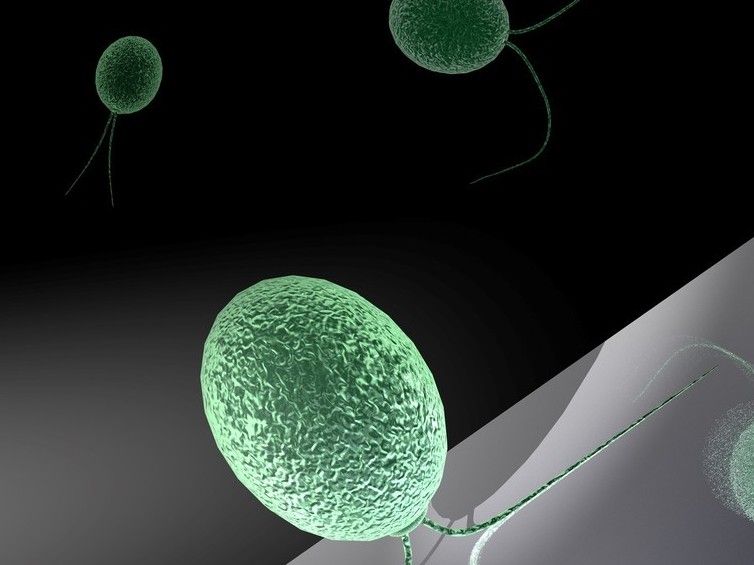
Grünalgen können Ihre Haftung an Oberflächen durch Licht an- und ausschalten. Im Licht kleben ihre beiden Härchen, Flagellen genannt, an einer Oberfläche, während die Algen in Dunkelheit mittels einer Art Brustschwimm-Bewegung durch das Wasser schwimmen.
© Oliver Bäumchen, MPIDS, Göttingen / Thomas Braun, Heidelberg
Im Alltag fallen Grünalgen eher unangenehm auf. Die mikroskopisch kleinen Einzeller bilden bei feuchter Witterung auf Gartenmöbeln und Hauswänden glitschige Beläge oder machen sich in warmen Sommern im Gartenteich und in Wasseraufbereitungsanlagen breit. Doch Grünalgen können auch nützlich sein. Seit Jahren kultiviert man sie in Bioreaktoren, in großen Anlagen aus Glasröhrensystemen, um aus den Algen Biotreibstoffe herzustellen. Allerdings haben die Algen eine Eigenschaft, die diesen Prozess erschwert: Sie halten sich mit kleinen Härchen, den Flagellen, an Oberflächen fest. In den Bioreaktoren führt das dazu, dass die Glasröhren mit der Zeit von einem grünen Belag überzogen werden, sodass weniger Licht in die Anlage eindringt. Durch diesen Biofilm nimmt die Photosyntheseleistung der übrigen Algen im Inneren der Anlage ab – der Bioreaktor ist weniger produktiv.
In rotem Licht haften Chlamydomonas-Grünalgen nicht
Ein Forscherteam unter der Leitung von Oliver Bäumchen Physiker am Göttinger Max-Planck-Institut für Dynamik und Selbstorganisation aber hat jetzt eine Entdeckung gemacht, die die Effizienz von Bioreaktoren künftig steigern könnte. „Bei Experimenten an Grünalgen haben wir festgestellt, dass die Algen nur unter bestimmten Lichtbedingungen klebrig sind und an Oberflächen haften können“, sagt Oliver Bäumchen.
Der Wissenschaftler befasst sich schon mehrere Jahre mit den Hafteigenschaften von Mikroorganismen. Er interessiert sich vor allem für die Funktionsweise der Flagellen und die Mechanismen, mit denen diese winzigen Härchen erstaunlich starke Haftkräfte aufbringen können. Diese Kräfte messen er und seine Mitarbeiter mit einem präzisen Sensor: einer hauchdünnen Mikroglaspipette, an der eine einzelne Grünalgen-Zelle festgesaugt werden kann. Wie groß die Kraft ist, um mit der Mikropipette die Zelle von einer Oberfläche abzuziehen, messen die Forscher.
Die Grünalge nimmt Licht mit verschiedenen Proteinen wahr
Dass sich das Anhaften der Algen an Oberflächen durch Licht steuern lässt, fand Bäumchens Doktorand Christian Kreis heraus. Er hatte mit der Grünalge Chlamydomonas experimentiert und festgestellt, dass die Algen immer nur in weißem Licht eine deutliche Haftkraft zeigten. In rotem Licht hingegen hielten sich die Zellen an den Oberflächen gar nicht fest. Zwar ist seit langem bekannt, dass sich viele Mikroorganismen am Licht orientieren und beispielsweise in Richtung einer Lichtquelle schwimmen. Dass sich aber der Haftmechanismus der Grünalgen durch Licht quasi an- und ausschalten lässt, war bislang völlig unbekannt.
Kreis untersuchte die Lichtreaktion genauer und stellte fest, dass Chlamydomonas bei Bestrahlung mit blauen Lichtanteilen an der Oberfläche klebt. Dieses Licht nimmt die Alge mit verschiedenen Proteinen wahr, speziellen lichtempfindlichen Eiweißen. „Wir denken, dass sich die Lichtschaltbarkeit durch die Evolution herausgebildet haben könnte“, sagt Christian Kreis. Im Gegensatz zum Phytoplankton im Meer leben diese artverwandten Mikroorganismen normalerweise in feuchten Böden, wo sie Oberflächen antreffen. „Liegen diese Oberflächen im Sonnenlicht können die Algen dank dieses cleveren Mechanismus einfach anhaften und Photosynthese betreiben”, erklärt der Forscher.
Algen mit veränderten Blaulichtrezeptoren könnten keine Biofilme bilden
Was die Bioreaktoren betrifft, liefert diese Erkenntnis allein noch keine Lösung, um zu verhindern, dass sich Algenbeläge an den Glaswänden bilden. Die Bioreaktoren nur mit dem rotem Licht, bei dem die Haftung ausgeschaltet ist, zu bestrahlen, funktioniert nicht, weil die Grünalgen für die Photosynthese auch blaues Licht brauchen. Oliver Bäumchen und Christian Kreis verfolgen deshalb einen anderen Weg. „Wir kooperieren nun mit Mikrobiologen, die seit langer Zeit an Grünalgen arbeiten“, sagt Bäumchen. „Gemeinsam wollen wir in nächster Zeit Zellen untersuchen, bei denen die verschiedenen Blaulichtrezeptoren blockiert sind, um herauszufinden, welche dieser Rezeptoren die Klebrigkeit der Algen tatsächlich auslösen.“ Gelänge es, Algen mit veränderten Blaulichtrezeptoren in großer Zahl zu züchten, dann könnte man diese möglicherweise künftig in Bioreaktoren einsetzen, ohne dass sich lästige Biofilme an den Oberflächen bilden.
Das Forscherteam um Oliver Bäumchen untersucht die schaltbare Klebrigkeit von Grünalgen aus verschiedenen Gründen: „Es ist allgemein interessant, das Phänomen der Haftung an Oberflächen zu verstehen, immerhin sind die Haftkräfte der Zellen im Verhältnis zu ihrer Größe enorm“, sagt Bäumchen. Er erforscht die Flagellen zudem, weil ihr Bauprinzip fast identisch mit dem der Flimmerhärchen im menschlichen Körper ist. Diese gibt es zum Beispiel in der Lunge.
Christian Kreis geht unterdessen den Möglichkeiten, nach die Bildung von Biofilmen durch Grünalgen zu verhindern. Er untersucht derzeit, ob sich die Klebrigkeit noch durch andere Reize als das Licht schalten lässt, etwa durch Oberflächen, die schwache elektrische Ladungen aufweisen. „Biofilme sind in vielen Anwendungen störend“, sagt der Forscher. „Gelänge es, Oberflächen so zu designen, dass die Klebrigkeit der Mikroorganismen ausgeschaltet wird, dann könnte das für viele Anwendungen in der Medizin, der Biotechnologie und der Prozesstechnik von großem Interesse sein.“