Nesseltiere steuern Bakterien fern
Forschungsteam belegt erstmals, dass Wirtstiere die Funktion ihrer bakteriellen Symbionten steuern können
In den modernen Lebenswissenschaften zeichnet sich immer deutlicher ein Paradigmenwechsel ab: Lebewesen gelten nicht mehr als in sich geschlossene Einheiten, sondern als hochkomplexe und funktionell voneinander abhängige Organismengemeinschaften. Die Erforschung der engen Verflechtungen zwischen vielzelligem und vor allem bakteriellem Leben wird in Zukunft den Schlüssel zu einem besseren Verständnis der Lebensprozesse insgesamt und insbesondere des Übergangs von Gesundheit und Krankheit liefern.

Der Süßwasserpolyp Hydra.
Dr. Sebastian Fraune
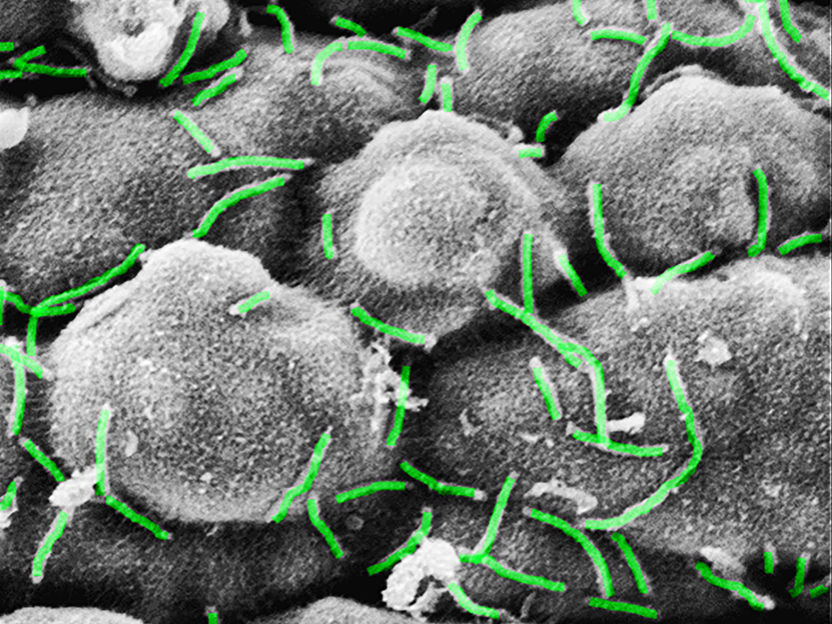
Elektronenmikroskopische Aufnahme der Bakterienbesiedlung (Curvibacter sp.) auf der Oberfläche von Hydra.
Katja Schröder

Wie die Zusammenarbeit und Kommunikation der Organismen dabei im Detail abläuft, ist gegenwärtig allerdings noch in großen Teilen unbekannt. Einen wichtigen Fortschritt bei der Entschlüsselung dieser multiorganismischen Beziehungen haben nun Forschende der Arbeitsgruppe Zell- und Entwicklungsbiologie am Zoologischen Institut der Christian-Albrechts-Universität zu Kiel (CAU) erzielt. Die Wissenschaftler um Dr. Sebastian Fraune konnten erstmals belegen, dass Wirtsorganismen neben der Zusammensetzung auch die Funktion ihrer sie besiedelnden Bakteriengemeinschaften steuern können. Ihre neuartigen Ergebnisse, die sie am Beispiel des Süßwasserpolypen Hydra und seiner spezifischen bakteriellen Symbionten gewinnen konnten, veröffentlichten die CAU-Forschenden in Proceedings of the National Academy of Sciences.
„Ausgangspunkt unserer Untersuchung war die Beobachtung, dass Hydra mit der Bildung bestimmter antimikrobieller Substanzen die Zusammensetzung einer arttypischen Bakterienbesiedlung auf seiner Körperoberfläche beeinflussen kann“, erklärt Dr. Cleo Pietschke, Erstautorin der Studie. Die evolutionär ursprünglichen Lebewesen bewältigen damit im Prinzip dieselbe Aufgabe, die auch höherentwickelte Organismen bei der Ausbildung eines gesunden Mikrobioms lösen müssen: Mithilfe ihres Immunsystems sorgen sie für die Ansiedlung der „richtigen“ Zusammensetzung von Bakterien und müssen zugleich nützliche Mikroorganismen darin hindern, schädlich zu wirken. Wie dieser Kolonisierungsprozess durch die Kommunikation zwischen Wirt und Bakterien unterstützt wird, stand im Mittelpunkt der vorliegenden Arbeit.
Ab einer bestimmten Dichte ihrer Population können Bakteriengemeinschaften in Teams agieren, um gemeinsam gewisse Funktionen zu erfüllen. Die Koordination dieser Funktionen beruht auf einem Sensor-Mechanismus, mit dem die einzelnen Bakterien mit Hilfe von Signalmolekülen die Populationsdichte insgesamt bestimmen können. Ist ein Schwellenwert erreicht, werden über diese Signalmoleküle Gene aktiviert und damit bestimmte zelluläre Funktionen reguliert. Mit diesem als Quorum-Sensing bezeichneten Prozess steuern Bakterien Funktionen wie die Besiedlung von Oberflächen oder die Produktion von Toxinen.
Das Kieler Forschungsteam konnte nun zeigen, dass der Wirtsorganismus den Quorum-Sensing-Mechanismus der Bakterien verändern kann. Die Nesseltiere wirken dabei direkt auf die bakteriellen Signalmoleküle ein und fördern so den Kolonisierungsprozess ihres eigenen Gewebes aktiv. „Wir haben festgestellt, dass Hydra nicht nur das reine Vorhandensein seiner bakteriellen Symbionten beeinflusst, sondern darüber hinaus regelrecht in ihre Funktion eingreifen kann“, erläutert Fraune, wissenschaftlicher Mitarbeiter in der Arbeitsgruppe Zell- und Entwicklungsbiologie, das Phänomen. Das Forschungsteam beschrieb erstmals detailliert, dass ein Wirt mittels Quorum-Quenching in die molekulare Kommunikation von Bakterien eingreift. Bisher gab es nur zwei andere Bespiele für solche Eingriffe eines Wirtsorganismus. Konkret wiesen die Kieler Forschenden nach, dass eine Modifikation bestimmter Signalmoleküle durch den Wirt die Ansiedlung des häufigsten bei dieser Hydrenart vorkommenden Bakteriums Curvibacter fördert.
Die CAU-Forschenden untersuchten den Einfluss des Wirtsmechanismus auf seine bakterielle Gemeinschaft, indem sie die Auswirkung eines Signalmoleküls und das vom Wirt modifizierte bakterielle Gegenstück beobachteten. Zunächst brachten sie sterile Hydren, also im Labor künstlich ohne Bakterienbesiedlung gezüchtete Tiere, mit Bakterien der Art Curvibacter in Kontakt. Es zeigte sich, dass die Bakterien sich nur schlecht ansiedelten, solange nicht modifizierte Signalmoleküle vorhanden waren. Sobald diese unter dem Einfluss des Wirtstieres modifiziert waren, besiedelten die Bakterien den Körper des Nesseltiers in einem normalen Umfang. Anschließend wiederholten die Forschenden den Versuch mit Tieren, die bereits eine Bakterienbesiedlung aufwiesen. Auch hier zeigte sich dasselbe Muster: Erst die vom Wirtstier veränderten Signalmoleküle fördern eine ausgewogene und typische Kolonisierung der Hydren durch ihre bakteriellen Symbionten. Wie sich diese am Modellorganismus des Nesseltiers gewonnenen Ergebnisse auf andere Lebewesen übertragen lassen, müssen weitere Untersuchungen zeigen. Da Hydren evolutionär ursprüngliche Tiere sind, ist es jedoch wahrscheinlich, dass dieser Mechanismus auch bei höher entwickelten Lebewesen in ähnlicher Weise angelegt ist.
„An der Schnittstelle von Grundlagenforschung und Medizin wird immer deutlicher, dass der Schlüssel zur Gesundheit in der Balance von Körper und bakteriellen Symbionten liegt. Vor uns liegt die gigantische Aufgabe, die höchst komplexen Beziehungen zwischen Wirten und Bakterien zu verstehen. Mit unseren neuen Erkenntnissen sind wir diesem Ziel ein kleines Stück nähergekommen“, gibt sich Fraune optimistisch. An der Erforschung der multiorganismischen Beziehungen von Körper und Mikroorganismen arbeiten rund 70 Kieler Wissenschaftlerinnen und Wissenschaftler gemeinsam im Sonderforschungsbereichs 1182 „Entstehen und Funktionieren von Metaorganismen“.
Originalveröffentlichung
Cleo Pietschke, Christian Treitz, Sylvain Forêt, Annika Schultze, Sven Künzel, Andreas Tholey, Thomas C. G. Bosch and Sebastian Fraune; “Host modification of a bacterial quorum-sensing signal induces a phenotypic switch in bacterial symbionts”; Proceedings of the National Academy of Sciences; Published on September 18, 2017