Sprechverbot für Bakterien
Forscher ebnen den Weg für neue Wirkstoffe, die Krankenhauskeime verstummen lassen
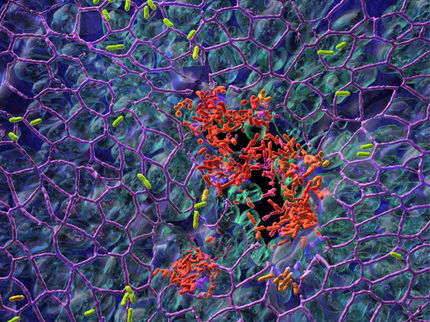
Immer mehr krankheitserregende Bakterien entwickeln Resistenzen gegen die gängigen Antibiotika. Einer dieser Problemkeime ist Pseudomonas aeruginosa, der beim Menschen schwere Infektionen auslöst und gleich gegen eine ganze Reihe von Antibiotika resistent ist. Daher suchen Forscher nach Angriffspunkten für alternative Wirkstoffe, die die Bakterien schwächen. Pseudomonaden können in sogenannten Biofilmen überdauern – das sind dichte Verbünde, in denen die einzelnen Bakterien vor dem Immunsystem und Medikamenten geschützt sind. Damit die Bakterien einen solchen Biofilm bilden können, müssen sie zunächst über Signalstoffe miteinander kommunizieren. Wissenschaftler des Helmholtz-Zentrums für Infektionsforschung (HZI) in Braunschweig haben die dreidimensionale Struktur eines Proteins aufgelöst, das an der Bildung der Signalmoleküle beteiligt ist. Anhand dieser Struktur ist es nun möglich, passgenaue Hemmstoffe zu modellieren, die den Signalweg unterbrechen und so die Bakterien stumm schalten können.
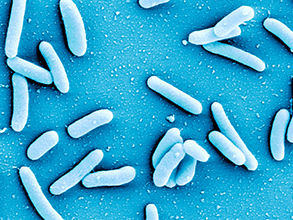
Bakterien der Art Pseudomonas aeruginosa entwickeln häufig Resistenzen gegen Antibiotika und schützen sich zudem in Biofilmen vor äußeren Einflüssen.
© HZI / Rohde
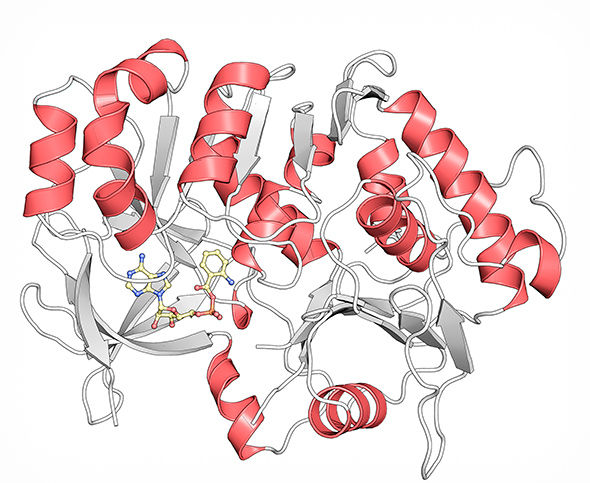
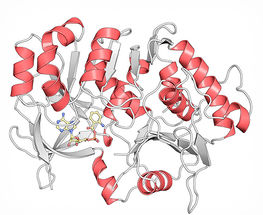
Kristallstruktur des Proteins PqsA in Komplex mit dem Intermediat Anthraniloyl-AMP (gelb), das von PqsA verarbeitet wird.
© HZI / Florian Witzgall
Im übertragenen Sinn sprechen auch Bakterien miteinander. Sie kommunizieren dabei nicht über akustische, sondern über chemische Signale. So stimmen sie zum Beispiel das Eindringen in einen Wirt oder ihre Vermehrung ab. Diese spezielle Art der Kommunikation wird „Quorum sensing“ genannt. Der Begriff „Quorum“ stammt aus der Zeit des römischen Reiches und bezeichnet im Senat die für eine Abstimmung benötigte geringste Zahl an Mitgliedern. Pseudomonaden veranlassen darüber auch die Bildung von Biofilmen, indem die einzelnen Bakterien Signalmoleküle freisetzen und messen, wie viele Artgenossen sich gerade in ihrer Umgebung aufhalten. Ist ein Schwellenwert überschritten, starten sie ihr Angriffsprogramm. Haben sich die Pseudomonaden erst zu einem Biofilm zusammengelagert, sind sie nur noch schwer zu bekämpfen – egal, ob durch das Immunsystem oder durch Medikamente, denn selbst Antibiotika sind gegen Erreger in Biofilmen oft wirkungslos. Allerdings bietet das Kommunikationssystem der Bakterien, das an der Biofilmbildung beteiligt ist, einen geeigneten Angriffspunkt für alternative Wirkstoffe: Sie könnten die Kommunikation unterdrücken, sodass die Bakterien für das Immunsystem und Antibiotika zugänglich bleiben.
„Herkömmliche Antibiotika greifen lebenswichtige Prozesse der Bakterien an, töten sie dadurch ab und erzeugen so einen Selektionsdruck, der die Bakterien dazu zwingt, Resistenzen gegen die Antibiotika zu entwickeln“, sagt Florian Witzgall, Doktorand in der HZI-Abteilung „Struktur und Funktion der Proteine“, die von Prof. Wulf Blankenfeldt geleitet wird. „Greift ein Wirkstoff dagegen in die Kommunikation der Bakterien ein, bleiben sie am Leben und werden nur unschädlich gemacht. Es bestünde vermutlich ein geringerer Druck zur Resistenzbildung.“
Bakterien nutzen verschiedene Systeme, um miteinander zu kommunizieren. Pseudomonas aeruginosa besitzt drei verschiedene Kommunikationssysteme, von denen eines für diesen Erreger spezifisch ist und als pqs-System (kurz für Pseudomonas Quinolone Signal) bezeichnet wird. Rund zehn Prozent aller Gene von Pseudomonas aeruginosa werden über interzelluläre Kommunikation reguliert, darunter viele Gene, die die Bakterien für die Infektion eines Wirtes benötigen. „Das pqs-System bietet sich als Angriffspunkt für Medikamente an, da es für Pseudomonas recht spezifisch ist, eine Vielzahl von Prozessen wie die Bildung von Virulenzfaktoren oder Biofilmen reguliert und der Mensch kein homologes System besitzt“, sagt Witzgall. Im pqs-System bilden verschiedene Proteine in mehreren Schritten ein Signalmolekül, über das die Bakterien miteinander kommunizieren und das durch die Aktivierung eines DNA-bindenden Rezeptors eine Vielzahl von Genen reguliert, die zum Beispiel das Infektionsprogramm von Pseudomonas steuern.
Die HZI-Forscher haben sich nun das erste Protein dieser Produktionskette vorgenommen und seine dreidimensionale Struktur entschlüsselt. Dazu haben sie das Protein – PqsA – im Labor von harmlosen Escherichia coli-Bakterien herstellen lassen, es isoliert, gereinigt und zum Kristallisieren gebracht. Besonders die Kristallbildung ist ein langwieriger Prozess, in dem die Wissenschaftler über 1000 verschiedene Bedingungen getestet haben, um zum gewünschten Ergebnis zu kommen. Anschließend haben sie die entstandenen Proteinkristalle mit Röntgenstrahlen beschossen und Streuungsmuster aufgenommen. Aus tausenden Streubildern ließ sich dann die dreidimensionale Molekülstruktur des Proteins berechnen. Insgesamt dauerte der Prozess rund acht Monate.
„Anhand der aufgeklärten Struktur wissen wir nun, wo und wie das Protein PqsA die Ausgangssubstanz für das spätere Signalmolekül bindet“, sagt Wulf Blankenfeldt. „Das macht es möglich, gezielt künstliche Moleküle am Computer zu entwerfen, die fest an PqsA binden und es nicht wieder verlassen können. So würde es in seiner Funktion blockiert und könnte keine Signalmoleküle mehr herstellen.“ Das Ergebnis: Die Bakterien wären ohne Signalmolekül nicht mehr in der Lage, sich gegenseitig wahrzunehmen – sie wären sozusagen taub-stumm. Die Entwicklung eines solchen Moleküls sei jetzt eine Aufgabe für die Wirkstoffforschung, die genau an den Ergebnissen der Strukturbiologen des HZI ansetzen könne.