Wirkungsweise des Impfstoff-Wirkverstärkers Flagellin in Fusionsproteinen aufgeklärt
Fusionsproteine bestehend aus Antigenen sowie dem bakteriellen Adjuvans Flagellin sind vielversprechende Impfstoffkandidaten. Sie haben das Potenzial, gezielt und zuverlässig Immunantworten auszulösen und so vor Infektionskrankheiten zu schützen. Zusätzlich können sie fehlgeleitete Immunreaktionen günstig beeinflussen, beispielsweise im Rahmen der Allergiebehandlung. Forscher aus dem Paul-Ehrlich-Institut haben den Wirkmechanismus eines solchen Kandidaten für die Behandlung von Birkenpollenallergien aufgeklärt.
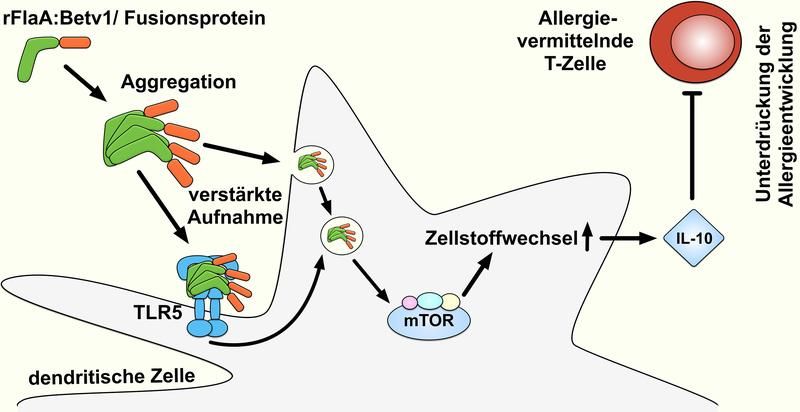
Das Fusionsprotein rFlaA:Betv1 unterdrückt allergische Reaktionen über eine mTOR-vermittelte Aktivierung des Zellstoffwechsels, die zu einer Produktion des entzündungshemmenden Zytokins IL-10 führt.
PEI
Um bei einer Impfung eine ausreichend starke Immunantwort auszulösen, muss entweder das Antigen, gegen das die Immunantwort gerichtet ist (zum Beispiel Krankheitserreger beziehungsweise Bestandteile davon), selbst eine ausreichend starke Immunantwort auslösen oder es müssen zusätzlich Wirkverstärker (Adjuvanzien) verabreicht werden. Solche Adjuvanzien sind virale, bakterielle oder chemische Bestandteile, die von unserem Immunsystem als fremd erkannt werden und dadurch Immunantworten auch gegen die gemeinsam applizierten Antigene einleiten.
Ein vielversprechendes Adjuvans ist das Protein Flagellin. Flagellin ist Hauptbestandteil langer spiralförmiger Proteinfäden auf der Oberfläche bestimmter Bakterien, sogenannter Flagellen. Sie dienen der Fortbewegung frei schwimmender Bakterien. Flagellin wird von dem Toll-like-Rezeptor 5 erkannt. TLR 5 gehört zu einer Gruppe von "Mustererkennungsproteinen", die sich u.a. auf Zellen des angeborenen Immunsystems befinden, Pathogene anhand charakteristischer Merkmale erkennen und so zuverlässig Immunantworten induzieren.
Flagellin hat den Vorteil, dass die für Flagellin kodierende Gensequenz mithilfe gentechnischer Verfahren mit Gensequenzen verschiedenster Antigene fusioniert werden kann. Hierdurch entstehen sogenannte Fusionsproteine, in denen das Antigen, gegen das eine Immunantwort ausgelöst werden soll, und Flagellin in einem Molekül fest miteinander verbunden sind. Zwar war schon mehrfach in Tiermodellen und klinischen Studien gezeigt worden, dass die Applikation solcher Fusionsproteine effizient Immunantworten gegen das enthaltene Antigen auslöst. Wie aber genau solche Fusionsproteine diese Immunantworten auslösen, war bisher weitgehend unbekannt.
Forschern aus dem Paul-Ehrlich-Institut um Dr. Stefan Schülke, Forschungsgruppe Molekulare Allergologie des Vizepräsidenten des Paul-Ehrlich-Instituts, Prof. Stefan Vieths, ist es im Verbund mit Forschern aus Mainz, Essen und Wien nun erstmals gelungen, den Wirkmechanismus eines solchen Fusionsproteins näher zu beschreiben. Hierfür untersuchten Schülke und Kollegen ein von ihnen entwickeltes Fusionsprotein aus Flagellin A (aus Listerien) und dem Hauptallergen aus Birkenpollen (Bet v 1).
Anders als beim Schutz vor Infektionskrankheiten geht es bei der "Impfung" mit Allergenen, die beispielsweise Heuschnupfen verursachen, darum, das Immunsystem zu stimulieren, um zu einer Gewöhnung/Toleranz gegenüber dem Allergen zu führen. Nachdem die Forscher zeigen konnten, dass ihr Fusionsprotein – nicht aber die Mischung beider Einzelproteine – in der Lage war, die Entstehung allergischer Antworten im Mausmodell effizient zu verhindern, untersuchten sie den Wirkmechanismus ihres Fusionsproteins. Vorarbeiten hatten bereits Hinweise darauf gegeben, dass die beobachtete Unterdrückung allergischer Antworten nach Immunisierung mit dem Fusionsprotein wahrscheinlich über die Freisetzung des Botenstoffs Interleukin-10 vermittelt wird. IL-10 ist ein körpereigenes Zytokin, das die Aufgabe hat, überschießende Immunantworten zu bremsen.
Durch komplexe immunologische Untersuchungen fanden die Wissenschaftler heraus, dass dendritische Zellen das als Aggregat vorliegende Fusionsprotein sehr viel besser aufnahmen als die unfusionierte Mischung beider Einzelproteine. Dendritische Zellen sind wichtige Immunzellen für die Einleitung von Immunantworten. Die Stimulation durch das Fusionsprotein führte zu einer sehr starken Aktivierung dieser Zellen, die in der Folge sowohl pro- als auch antientzündliche Zytokine ausschütteten.
In weiterführenden Experimenten konnte das Forscherteam zeigen, dass es in dendritischen Zellen, die mit dem Fusionsprotein stimuliert worden waren, zu einer verstärkten Aktivierung des Zellstoffwechsels kam. Dieser als Warburg-Effekt bezeichnete Zustand einer erhöhten metabolischen Aktivität wurde durch die Aktivierung des mTOR1-Komplexes verursacht. Der mTOR1-Komplex ist ein zentraler Regulator der Stoffwechselaktivität in allen Körperzellen und ist auch für die Einleitung von Immunantworten bedeutsam.
Um die Rolle des mTOR1-Komplexes bei der durch das Fusionsprotein eingeleiteten Zytokinfreisetzung zu untersuchen, behandelten die Wissenschaftler dendritische Zellen mit Rapamycin, einem spezifischen Inhibitor der mTOR1-Aktivierung: Während sich die Freisetzung des entzündungshemmenden IL-10 durch Rapamycin hemmen ließ, war die Produktion entzündungsfördernder Zytokine von dieser Behandlung unbeeinflusst. Zusammengenommen zeigen diese Ergebnisse, dass die durch das Fusionsprotein vermittelte IL-10-Produktion durch die Aktivierung des Zellstoffwechsels in den dendritischen Zellen verursacht wurde.
"Dieses für uns überraschende Ergebnis zeigt zum ersten Mal, dass die immunmodulierende Aktivität eines Flagellin enthaltenden Impfstoffkandidaten durch die Aktivierung des Zellstoffwechsels vermittelt werden kann. Dieses Wissen kann dazu beitragen, die bei der Anwendung solcher Impfstoffkandidaten auftretenden komplexen immunologischen Prozesse besser zu verstehen und die Entwicklung neuer Impfstoffkandidaten zu unterstützen", erläutert Schülke die Relevanz der Ergebnisse.