Dem HIV-Protein NEF auf der Spur
Forscher entdecken wichtige Rolle des bislang unbeachteten Proteins
Weltweit leben rund 37 Millionen Menschen mit einer HIV-Infektion. Bisher lässt sich die damit verbundene Krankheit, das erworbene Immunschwächesyndrom (AIDS), nur mit Medikamenten behandeln – aber nicht heilen. Damit bleibt das Humane Immundefizienz-Virus eine der größten Herausforderungen für das öffentliche Gesundheitswesen. Das virale Eiweiß NEF (Negativer Faktor) gilt als wichtiger Virulenzfaktor, der entscheidend zum Krankheitsverlauf beiträgt. Wissenschaftler am Jülicher Institute of Complex Systems und am Düsseldorfer Institut für Physikalische Biologie haben nun entdeckt, dass NEF einen bestimmten Interaktionspartner benötigt, um an die Plasmamembran der Wirtszelle zu gelangen: das sogenannte GABA(A)-Rezeptor-assoziierte Protein (GABARAP). Schalten die Forscher das Protein aus, gelangt NEF nicht mehr an die Innenseite der Plasmamembran. Der in der Fachzeitschrift Scientific Reports veröffentlichte Artikel trägt dazu bei, sowohl die Funktionen des viralen als auch des menschlichen Proteins besser zu verstehen.
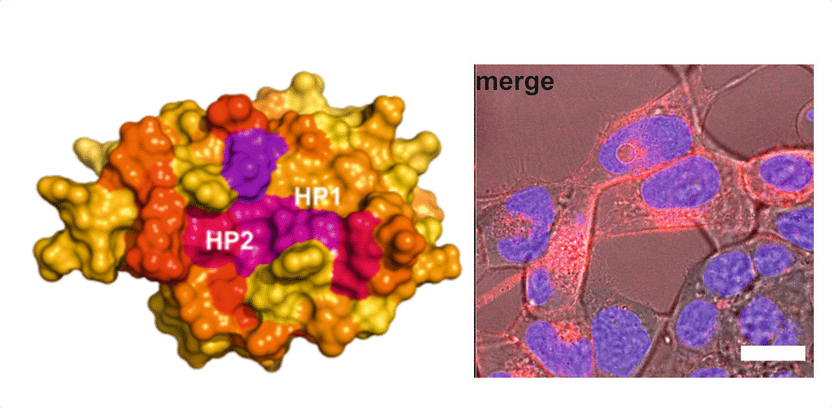
Abbildung links: HIV-1 NEF nutzt die bereits identifizierten hydrophoben Taschen 1 und 2 für die Bindung an GABARAP. In der Abbildung wurden die für die Bindung von GABARAP relevanten Aminosäuren angefärbt. Reste, die von der Bindung stark beeinflusst wurden, sind in lilafarben und Reste, die von der Interaktion unbeeinflusst sind, in gelb dargestellt. Abbildung rechts: Fluoreszenzmikroskopische Aufnahme einer HIV-1 NEF-exprimierenden Zelle. HIV-1 NEF (rot) lokalisiert aufgrund seiner vielen Wirkorte an der Plasmamembran, in der Nähe des Zellkerns und in vesikulären Strukturen an der Plasmamembran.
Copyright: Forschungszentrum Jülich / Heinrich-Heine-Universität Düsseldorf
Lange galt NEF für den HIV-Krankheitsverlauf als unwichtig, daher auch sein Name: Negativer Faktor; ein kleines virales Protein, ohne enzymatische Funktion, das abhängig vom Virusisolat aus 200 bis 280 Aminosäuren besteht und zu den weniger als 20 HI-Virus-Proteinen gehört. Inzwischen weiß man aber, dass NEF eine der wichtigsten Proteinkomponenten des HI-Virus ist. Es manipuliert menschliche Immunzellen auf vielfältige Weise und trägt dadurch zur effektiven Ausbreitung und hohen Virulenz von HIV im Menschen bei.
Damit NEF einen Teil seiner Funktionen ausüben kann, muss es an die Innenseite der Zelloberfläche der infizierten Zelle gelangen. Wie ihm das effizient gelingt, welche Mechanismen dafür notwendig sind, ist bisher unbekannt. Die Jülicher Arbeitsgruppe um Silke Hoffmann vom Institute of Complex Systems, Bereich Strukturbiochemie (ICS-6), hat nun in menschlichen Zellsystemen nachgewiesen, dass NEF das Wirtsprotein GABARAP oder seine nahen Verwandten GABARAPL1 und -L2 benötigt, um an der Zellmembran anzudocken. "Und nur wenn NEF an der Plasmamembran lokalisiert ist, kann es die Herabregulierung des Immunsystems beispielsweise durch den Abtransport wichtiger Oberflächenrezeptoren wie CD4 oder MHC-I initiieren", erklärt Hoffmann.
Wie wichtig NEF für den Krankheitsverlauf ist, spiegeln auch jene Patienten wider, die mit Virusisolaten infiziert sind, bei denen das NEF-Protein fehlerhaft zusammengesetzt ist: "Diese Menschen können das HI-Virus sehr lange in sich tragen, ohne dass die Krankheit ausbricht", erklärt Hoffmann. Von daher besteht in der Wissenschaft großes Interesse, die unterschiedlichen NEF-Funktionen zu entschlüsseln – ein riesiges Puzzle. "Umso erstaunter waren wir, mit GABARAP, einem an unserem Institut seit vielen Jahren auf strukturbiologischer Ebene untersuchtem Protein, einen humanen Interaktionspartner zu finden, von dem wir sagen können: Nehmen wir ihn und seine nahen Verwandten aus unseren Zelllinien heraus, gelangt NEF nicht mehr an einen für seine Wirkung wichtigen Ort in der Zelle", erklärt Alexandra Boeske, die die entscheidenden Experimente am ICS-6 durchgeführt hat und derzeit an der Heinrich-Heine-Universität Düsseldorf (HHU) arbeitet. Vor dem Hintergrund, dass die Lokalisation von NEF an der Plasmamembran so wichtig für viele Effekte der HIV-Pathogenese ist, ein entscheidender Erkenntnisgewinn.
Die Wissenschaftler konnten am Biomolekularen NMR-Zentrum in Jülich auch die Bindestelle für HIV-NEF auf der Moleküloberfläche von GABARAP identifizieren, die entsprechende 3D-Struktur von GABARAP war dort bereits früher entschlüsselt worden. Im nächsten Schritt wollen die Forscher in Kooperation mit Virologen untersuchen, ob infizierte Zellen in Abwesenheit von GABARAP auch tatsächlich keine Herabregulierung von Immunrezeptoren und damit des Immunsystems mehr aufweisen. "Dies würde unsere vermutete Bedeutung von GABARAP in dem Prozess im biologisch relevanten System beweisen", so Hoffmann.
GABARAP selbst gehört zu einer Proteinfamilie, die an intrazellulären Transportprozessen sowie an der Autophagie beteiligt ist, also jenem Vorgang, bei dem Zellen eigene Bestandteile abbauen und wiederverwerten, aber auch nutzen, um Viren und Bakterien zu bekämpfen. Zudem scheinen Zellen zumindest Teile des autophagischen Prozesses für die Sekretion von Proteinen einzusetzen. Passend dazu haben die Forscher beobachtet, dass das Fehlen von GABARAP nicht nur verhindert, dass NEF an der Zellmembranen lokalisiert, sondern auch den Transport des viralen Proteins nach außen in den extrazellulären Raum, wo NEF bekannter Weise nichtinfizierte Zellen schädigt und so ebenfalls entscheidend zur Pathogenese beiträgt. Den genauen Zusammenhang zwischen Autophagie, GABARAP und NEF-Sekretion wollen die Struktur- und Molekularbiologen zeitnah in einer weiteren Veröffentlichung darlegen.
Originalveröffentlichung
Alexandra Boeske, Melanie Schwarten, Peixiang Ma, Markus Tusche, Jessica Mötter, Christina Möller, Philipp Neudecker, Silke Hoffmann und Dieter Willbold; "Direct binding to GABARAP family members is essential for HIV-1 Nef plasma membrane localization"; Scientific Reports; 7, Article number: 5979 (2017)