Molekulare Trojaner machen Infektionen sichtbar
Neue Wirkstoffe, um multiresistente Bakterien zu lokalisieren und zu behandeln
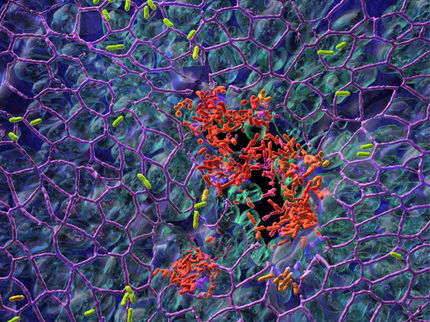
Multiresistente gramnegative Bakterien sind besonders schwer mit Antibiotika zu bekämpfen. Ein Wirkstoff muss zunächst eine doppelte Zellwand durchdringen, um eine Wirkung zu erzielen. Zudem gibt es Infektionen, deren Diagnose erschwert ist, weil sie im Körper schlecht zugänglich sind. Eine vielversprechende Strategie für deren Detektion und Bekämpfung besteht darin, molekulare Sonden mit theranostischen Eigenschaften einzusetzen: Diese erlauben eine simultane Diagnose und Therapie der Infektion im frühen Stadium. Wissenschaftler des Helmholtz-Zentrums für Infektionsforschung (HZI) und des Deutschen Zentrums für Infektionsforschung (DZIF) haben jetzt spezielle molekulare Modellsonden entwickelt, die das Eisentransportsystem von Bakterien nutzen, um antibakterielle Wirkstoffe in eine Bakterienzelle zu schleusen. Gleichzeitig können die „molekularen Trojaner“ Fluoreszenz-Markierungen tragen und so Infektionen in kleineren Tieren sicht- und behandelbar machen. In zukünftigen Studien sollen die antibakteriellen Eigenschaften der molekularen Sonden noch verbessert und ihre Anwendbarkeit zur molekularen Bildgebung von Infektionen in größeren Tieren bis zum Menschen weiterentwickelt werden.
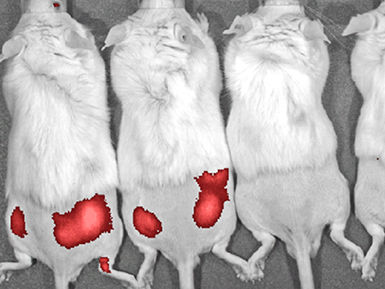
Kleintiermodell zur Diagnose bakterieller Infektionen: Die beiden linken Mäuse sind mit Pseudomonas aeruginosa infiziert, fluoreszenzmarkierte Siderophor-Konjugate machen die Bakterien ohne Eingriff im Körper sichtbar.
HZI / Bushra Rais
Einige pathogene Bakterien verursachen Infektionen, die eine ernsthafte gesundheitliche Bedrohung darstellen. Dieses Infektionsrisiko wird in Zukunft sogar noch ansteigen aufgrund der ständig zunehmenden internationalen Mobilität. Auch moderne medizinische Behandlungen, die die biologischen Körperbarrieren durchdringen und das Immunsystem schwächen, stellen ein ernstzunehmendes Problem dar. Anlass zur Sorge gibt dabei außerdem, dass der Anteil multiresistenter Krankheitserreger steigt, während die Anzahl zugelassener neuer Antibiotika rückläufig ist.
Besonders schwer sind multiresistente gramnegative Bakterien zu bekämpfen, zu denen auch Escherichia coli oder Pseudomonas aeruginosa gehören. Sie besitzen zwei Zellmembranen, die es einem potenziellen Wirkstoff erschweren, zum Zielort durchzudringen und seine Wirkung zu erzielen. Dadurch sind die Anforderungen an mögliche Wirkstoffe wesentlich komplexer als bei den grampositiven Bakterien, die nur eine Zellmembran besitzen.
„Es fehlt an effizienten Methoden, um Infektionen sicher diagnostizieren zu können, die schwer zugänglich und beispielsweise durch Biopsien nicht erreichbar sind. Das betrifft zum Beispiel Infektionen an Implantaten oder Endokarditis, eine Entzündung der Herzinnenhaut“, sagt Prof. Mark Brönstrup. „Um diese Infektionen in frühen Stadien sehen zu können, sind nicht-invasive Bildgebungsverfahren mithilfe von molekularen Sonden vielversprechend, da sie eine schnelle Behandlung ermöglichen könnten, noch bevor es zu einer Festsetzung der Infektion durch Biofilme oder einer Ausbreitung im Körper kommt.“ Brönstrup leitet am HZI die Abteilung „Chemische Biologie“ und hat eine DZIF-Professur inne.
HZI-Forschern ist es nun gelungen, einen multifunktionalen Wirkstoff zu entwickeln unter Nutzung des natürlich vorkommenden Eisentransportsystems von Bakterien. „Mikroorganismen brauchen ständig viele Eisenionen. Um ihren Bedarf zu decken, scheiden sie biosynthetisch hergestellte Siderophore aus. Diese niedermolekularen Verbindungen fangen das Eisen aus der Umgebung ein. Die Bakterienzelle nimmt den Eisen-Siderophor-Komplex dann aktiv auf“, sagt Mark Brönstrup.
Ein ganzes Arsenal an Transportern ermöglicht es den Bakterien, nicht nur zelleigene Siderophore einzufangen, sondern auch zellfremde, um ihren Eisenbedarf krisensicher zu bedienen. „Dies bietet uns die große Chance, künstliche Wirkstoffe zu designen, die die Bakterienzelle ohne Probleme aufnimmt. Unsere Strategie erinnert an das Trojanische Pferd: An künstliche Wirkstoffkomplexe können wir nach Bedarf auch einen antibiotischen Effektor anhängen, der unerkannt in die Bakterienzelle geschleust wird und antibakteriell wirkt“, sagt Brönstrup.
Die von den HZI-Forschern entwickelte molekulare Sonde basiert auf einem Siderophor-Konjugat, an welche sie funktionelle Einheiten anhängen können. „Unsere Sonden sind sogenannte Biomimetika. Mit ihnen ahmen wir erfolgreich biologische Stoffe aus der Natur nach. Das Gerüst unserer Sonde ist dabei sehr flexibel und kann vielseitig genutzt werden durch multiple Möglichkeiten der chemischen Synthese“, sagt Kevin Ferreira, Wissenschaftler im Team von Mark Brönstrup und Erstautor der Studie. „Die Sonden können sowohl ein Metallion als auch einen antibiotischen Wirkstoff in eine gramnegative Bakterienzelle schleusen.
Mit der neu entwickelten Methode können die HZI-Forscher nun Infektionen in vitro oder auch durch bildgebende Verfahren in größeren und kleineren Tieren sichtbar machen. Um bakterielle Infektionen in vivo zu verfolgen, wurden beispielsweise mit Pseudomonas aeruginosa infizierte Mäuse untersucht. Die bakterielle Infektion wurde mikroskopisch über ein Floureszenzlabel sichtbar gemacht. Das Prinzip funktioniert sehr gut in kleinen Tieren wie Mäusen. Auf diese Weise konnten die Forscher einen ersten konzeptionellen Beweis für die in vivo-Bildgebung bakterieller Infektionen durch Siderophor-Targeting erbringen. Für das Prinzip der neu entwickelten Modellsonde haben die HZI-Forscher bereits ein Patent angemeldet.
In zukünftigen Studien sollen die antibakteriellen Eigenschaften der Konjugate durch den Einbau hochpotenter Effektor-Moleküle in Folgegenerationen noch verbessert werden. Außerdem werden künftige Untersuchungen auf Analoga mit metallgebundenen Kernen ausgerichtet, die zur molekularen Bildgebung von Infektionen in größeren Tieren bis zum Menschen geeignet sind.