"Spermien-Fallen" fangen unbrauchbare Samenzellen ein
Amyloid-Fibrillen helfen bei der Beseitigung der unliebsamen Konkurrenz
Von den Millionen männlicher Samenzellen im Sperma, die sich zur Befruchtung auf den Weg zur Eizelle machen, wird nur eine einzige ihr Ziel erreichen und mit ihr verschmelzen. Dabei gilt: wer zuerst kommt, mahlt zuerst. Gut, wenn unliebsame Konkurrenz dabei auf der Strecke bleibt. Wissenschaftler der Universität Ulm und der University of California San Francisco (UCSF) haben nun herausgefunden, dass klebrige Eiweiß-Fäden unbrauchbare und beschädigte Spermien "einfangen" und damit deren Entsorgung durch die weibliche Immunabwehr erleichtern. Dies verschafft der gesunden Konkurrenz möglicherweise einen entscheidenden Vorteil im Kampf um die biologische Pole-Position beim Sperma-Rennen zur weiblichen Eizelle.
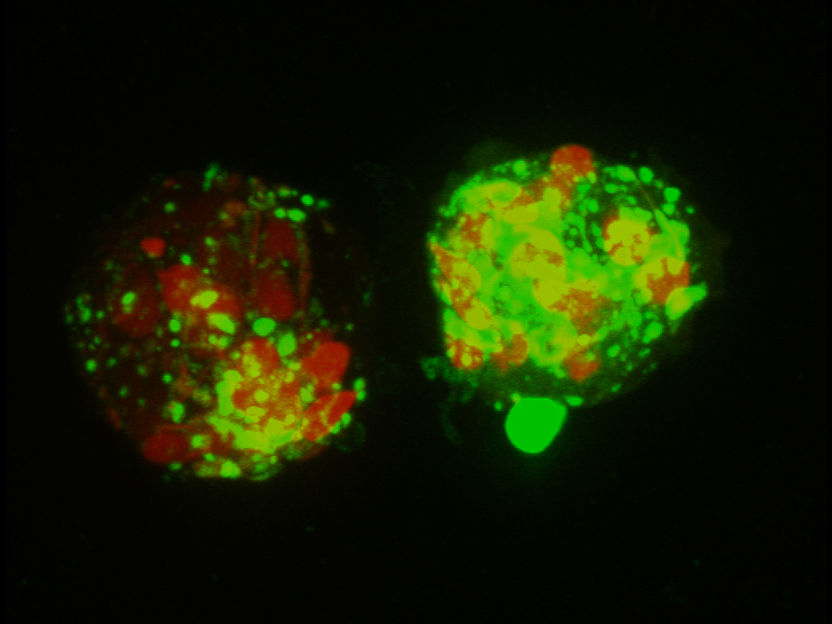
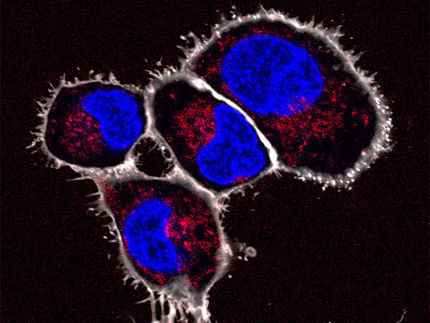
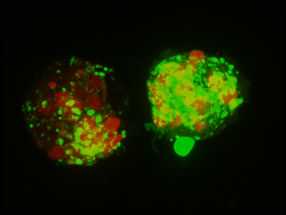
Fluoreszenz-mikroskopische Aufnahme (Mauricio Montano – Gladstone Institutes) von Makrophagen beim Verzehr von Spermazellklumpen mit Amyloid-Anhaftungen
Universität Ulm
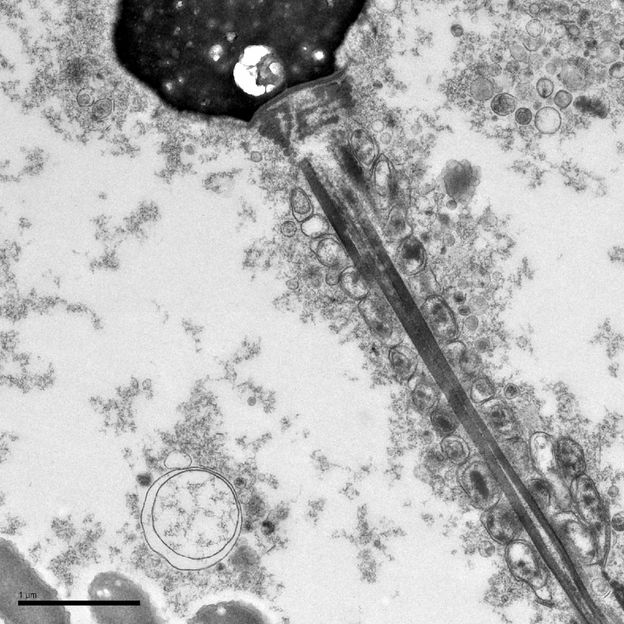
Die EM-Aufnahme (Jinny Wong – Gladstone Institutes) zeigt ein Spermium mit angelagertem Amyloid
Universität Ulm
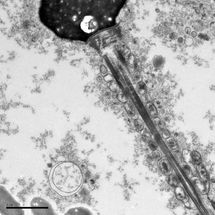
Diese "Spermien-Fallen" bestehen aus so genannten Amyloid-Fibrillen. Das sind faserartige Gebilde aus fehlgefalteten Proteinen, die sich zu "klebrigen", unlöslichen Eiweiß-Aggregaten verbinden. "Bisher war von diesen klebrigen Eiweißstäbchen im Sperma nur bekannt, dass sie als HIV-Verstärker wirken, indem sie die Anheftung der AIDS-Erreger an die Zielzellen erleichtern", erklärt Professor Jan Münch vom Ulmer Institut für Molekulare Virologie, der gemeinsam mit Institutsleiter Professor Frank Kirchhoff die AIDS-fördernde Wirkung dieser Amyloid-Fibrillen im Sperma vor 10 Jahren aufgedeckt hat. Gemeinsam mit seinen kalifornischen Forschungskollegen ist Münch nun einer natürlichen biologischen Funktion dieser Eiweiß-Fäden auf die Spur gekommen.
"Wir konnten mit unserer Forschung nachweisen, dass im Sperma vorkommende Amyloid-Fibrillen beschädigte und überflüssige Spermien an der Fortbewegung hindern. Die unbrauchbaren Samenzellen werden festgehalten und schließlich von den Makrophagen, den Fresszellen des Immunsystems, verzehrt und somit beseitigt", erklärt Nathallie Sandi-Monroy. Die Ulmer Doktorandin teilt sich mit ihren kalifornischen Fachkollegen Nadia R. Roan und Nargis Kohgadai die Erstautorschaft der Studie. "So wie es aussieht, helfen diese Protein-Fasern bei der Spermien-Selektion und verschaffen damit den gesunden Samenzellen einen gewissen Fortpflanzungsvorteil", fasst Professor Münch die Ergebnisse zusammen.
Amyloid-Fibrillen helfen bei der Beseitigung von überschüssigem Sperma
Außerdem sorgen die Amyloid-Fibrillen wohl auch dafür, dass überschüssiges Sperma, das für die Fortpflanzung nicht geeignet ist, oder nicht mehr gebraucht wird, schneller abgebaut werden kann. Denn für den weiblichen Organismus sind männliche Samenzellen vor allem eines: Fremdkörper und Eindringlinge mit hohem Antigen-Potential, die das Immunsystem herausfordern und daher nach dem Befruchtungsakt so schnell wie möglich zu beseitigen sind.
"Mit unseren Ergebnissen konnten wir außerdem nachweisen, dass Amyloid-Fibrillen, die bislang nur als Auslöser von Krankheiten bekannt sind, auch wichtige biologische Funktionen im Organismus erfüllen können", betont Professor Warner C. Greene und weist in diesem Zusammenhang auf Krankheiten wie Alzheimer, Parkinson oder sogenannte Amyloidosen hin. Der Direktor des Gladstone Instituts für Virologie und Immunologie an der University of California San Francisco (UCSF) ist gemeinsam mit dem Ulmer Professor Jan Münch für die wissenschaftliche Leitung der Studie verantwortlich. "Weil Amyloid-Fibrillen aber auf natürliche Weise im Sperma vorhanden sind, haben wir schon damit gerechnet, dass sie eine gewisse Rolle bei der Fortpflanzung spielen könnten. Das konkrete Ergebnis hat uns dann allerdings doch sehr überrascht", sind sich die Wissenschaftler einig.
Im neuen SFB 1279 forschen die Ulmer Wissenschaftler zu körpereigenen Peptiden
Die zukünftige Forschung zur biochemischen Funktion dieser besonderen Proteinaggregate ist eingebettet im neuen Sonderforschungsbereich (SFB) 1279 der Universität Ulm. Der von der Deutschen Forschungsgemeinschaft mit über 12 Millionen Euro geförderte SFB trägt den Titel "Nutzung des menschlichen Peptidoms für die Entwicklung neuer antimikrobieller und anti-Krebs-Therapeutika". Im Mittelpunkt des zunächst auf vier Jahre angelegten Verbundvorhabens steht die interdisziplinäre Forschung zu körpereigenen Peptiden und deren Potential für die Behandlung von Krebs und Infektionskrankheiten. Dabei geht es nicht zuletzt um die Aufklärung der biochemischen Funktionen dieser Eiweißbausteine sowie deren Optimierung für den therapeutischen Einsatz. Ein Aspekt wird dabei die Klärung der biologischen Rolle und natürlichen Funktion von Amyloid-bildenden Peptiden sein. Sprecher des SFB 1279 ist Professor Frank Kirchhoff, der Leiter des Instituts für Molekulare Virologie der Ulmer Universitätsmedizin.
Originalveröffentlichung
Roan NR, Sandi-Monroy N, Kohgadai N, Usmani SM, Hamil KG, Neidleman J, Montano M, Ständker L, Röcker A, Cavrois M, Rosen J, Marson K, Smith JF, Pilcher CD, Gagsteiger F, Sakk O, O'Rand M, Lishko PV, Kirchhoff F, Münch J, Greene WC; "Semen amyloids participate in spermatozoa selection and clearance"; eLife 06/27/17