Bahnbrechende Untersuchungsmethode beschleunigt Proteinanalyse um ein Vielfaches
Forscher entschlüsseln erstmals intaktes Virus atomgenau mit Röntgenlaser
Ein internationales Forscherteam hat erstmals mit einem Röntgenlaser die atomgenaue Struktur eines intakten Viruspartikels entschlüsselt. Die verwendete innovative Methode reduziert die für die Analyse nötige Menge an Virusmaterial drastisch und beschleunigt die Untersuchung um ein Vielfaches. Dies eröffne völlig neue Forschungsmöglichkeiten, schreibt das Team unter der Leitung von DESY-Wissenschaftler Alke Meents im Fachblatt „Nature Methods“.
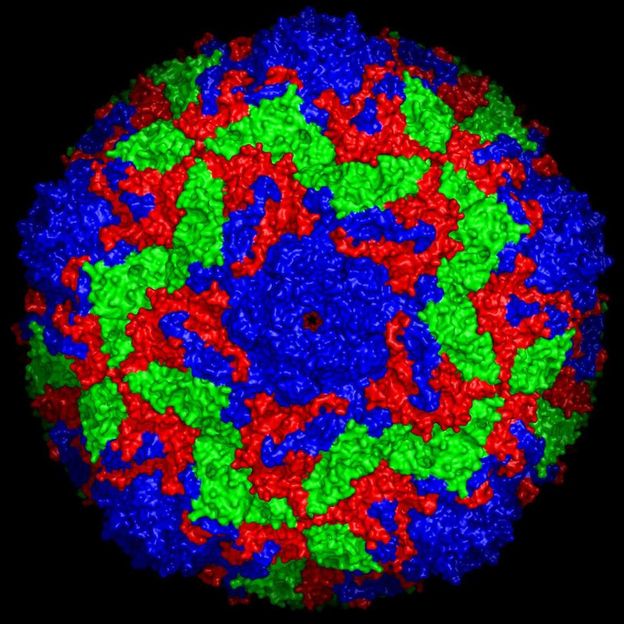
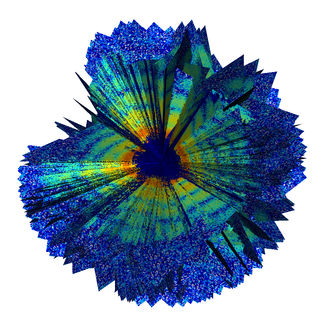
Oberflächenstruktur des Bovinen Enterovirus 2, die drei Virusproteine sind farbig markiert.
Jingshan Ren, University of Oxford
In der sogenannten Strukturbiologie untersuchen Forscher die räumliche Struktur von Biomolekülen, um daraus deren Funktionsweise zu entschlüsseln. Dieses Wissen nützt dem Verständnis fundamentaler biologischer Vorgänge im Organismus wie beispielsweise dem Transport von Material in die und aus der Zelle und kann auch zur Entwicklung neuer Medikamente beitragen: „Die Kenntnis der dreidimensionalen Struktur eines Proteins gibt einzigartige Einblicke in seine biologische Funktion“, erläutert Ko-Autor David Stuart, Life-Science-Direktor am britischen Synchrotron Diamond Light Source und Professor an der Universität Oxford. „Wenn wir beispielsweise die Struktur eines Proteins kennen, mit dem sich das Virus an eine Zelle ‚anhakt‘, versetzt uns das möglicherweise in die Lage, einen Schutz für die Zelle zu entwickeln, sodass das Virus unfähig ist, sie anzugreifen.“
Die bei weitem ergiebigste Methode der Strukturbiologie ist die Röntgenkristallographie, mit der bereits tausende Strukturen von Biomolekülen bestimmt worden sind. Hierbei werden kleine Kristalle aus den zu untersuchenden Proteinen gezüchtet und mit hochenergetischem Röntgenlicht beleuchtet. Die Kristalle streuen die Röntgenstrahlung auf charakteristische Weise, sodass sich aus den entstehenden Beugungsmustern die räumliche Struktur des Kristalls – und somit seiner Bestandteile – atomgenau berechnen lässt. Allerdings sind Proteinkristalle nicht so stabil und unempfindlich wie beispielsweise Salzkristalle. Sie sind schwer zu züchten, bleiben oft winzig klein und werden schnell von der energiereichen Röntgenstrahlung beschädigt.
„Röntgenlaser haben einen neuen Zugang zur Protein-Kristallographie ermöglicht, weil sich mit ihren extrem intensiven Blitzen auch noch winzigste Kristalle analysieren lassen, die an anderen Röntgenlichtquellen kein ausreichend helles Streubild erzeugen“, betont Armin Wagner von der Diamond Light Source, ebenfalls Koautor der Studie. Jeder dieser Mikrokristalle kann allerdings nur ein einziges Streubild liefern, weil er danach im Röntgenlaserblitz verdampft. Für eine Strukturanalyse sind in der Regel aber hunderte bis tausende Streubilder nötig. Daher schießen Forscher bei derartigen Untersuchungen in der Regel einen feinen Flüssigkeitsstrahl mit Proteinkristallen durch den gepulsten Laser, der in schneller Folge ultrakurze Röntgenblitze abfeuert. Jedes Mal, wenn ein Röntgenblitz zufällig einen Mikrokristall trifft, entsteht ein Streubild und wird aufgezeichnet.
Das Problem bei dieser grundsätzlich sehr erfolgreichen Methode, mit der bereits die Strukturen von mehr als 80 Biomolekülen entschlüsselt worden sind: „Die Trefferquote liegt typischerweise bei unter einem Prozent der Röntgenblitze, womit die meisten der kostbaren Mikrokristalle ungenutzt im Auffangbehälter landen“, sagt Meents vom Hamburger Center for Free-Electron Laser Science (CFEL), einer Kooperation von DESY, Universität Hamburg und Max-Planck-Gesellschaft. Die bisher angewandten Methoden benötigen daher typischerweise mehrere Stunden Messzeit und deutlich mehr Probenmaterial, um die Struktur zu entschlüsseln.
Um kostbare Messzeit und Probenmaterial effizienter einzusetzen, hat das Team um DESY-Physiker Meents ein neues Verfahren entwickelt: Die Wissenschaftler verwenden einen mikrostrukturierten Chip mit tausenden winzig kleiner Poren, auf die sich die Proteinkristalle verteilen. Der Chip wird mit dem Röntgenlaser dann so abgerastert, dass im Idealfall mit jedem Schuss des Lasers ein Streubild aufgenommen wird.
Die Forscher testeten ihre Methode mit zwei unterschiedlichen Viren am Röntgenlaser LCLS des US-Forschungszentrums SLAC, der 120 Röntgenblitze pro Sekunde liefert. Sie beluden ihren Probenhalter mit einer kleinen Menge an Mikrokristallen des Bovinen Enterovirus 2 (BEV2), welches Fehl- und Totgeburten sowie Unfruchtbarkeit bei Rindern auslösen kann und schwer zu kristallisieren ist. Bei der Untersuchung erzielten die Wissenschaftler eine Trefferquote von bis zu neun Prozent. In nur 14 Minuten sammelten sie so genug Daten, um die – bereits aus Untersuchungen an konventionellen Röntgenlichtquellen bekannte – Struktur des Virus mit einer Detailgenauigkeit von 0,23 Nanometern (millionstel Millimetern) zu bestimmen.
„Unseres Wissens ist dies die erste atomgenaue Struktur eines intakten Viruspartikels, die an einem Röntgenlaser bestimmt werden konnte“, betont Meents. „Während frühere Untersuchungen an anderen Röntgenlichtquellen Kristalle mit einem Gesamtvolumen von 3,5 Nanolitern benötigt haben, sind wir mit sehr viel kleineren Kristallen mit einem Gesamtvolumen von 228 Pikolitern ausgekommen. Das ist über zehn Mal weniger.“
Die Untersuchung der Virus-Kristalle erfolgte dabei bei Raumtemperatur. Eine Tiefkühlung, welche in der Röntgenkristallographie normalerweise eingesetzt wird, um Strahlenschäden an den Proteinkristallen zu verringern, ist für die hochempfindlichen Kristalle von Viren oft nicht möglich. Kristalle, die aus einzelnen Virusproteinen bestehen, sind hingegen robuster und können sich gut kühlen lassen. In einem zweiten Test untersuchte das Forscherteam um Meents daher das Virus-Protein Polyhedrin, welches als Grundbaustein für einen porösen Container dient, in dem sich bis zu mehrere Tausend Viruspartikel verschanzen können. Die Viren nutzen diese Container als Schutz vor externen Umwelteinflüssen und sind somit in der Lage, auch bei widrigsten Bedingungen über längere Zeit intakt zu bleiben.
Die Wissenschaftler beluden ihren Chip mit Polyhedrin-Kristallen und untersuchten sie mit dem Röntgenlaser während der Chip bei Temperaturen unter minus 180 Grad Celsius gehalten wurde. Bei dieser Untersuchung erreichten die Forscher eine Trefferquote von bis zu 90 Prozent. In nur zehn Minuten hatten sie mehr als genug Streubilder des Polyhedrins aufgezeichnet, um die Proteinstruktur auf 0,24 Nanometer genau bestimmen zu können. „Für die Polyhedrin-Struktur haben wir nur einen einzigen Chip abscannen müssen, der mit vier Mikrogramm Proteinkristallen beladen war. Das ist Größenordnungen unter der üblicherweise benötigten Menge“, erläutert Meents.
„Unser Ansatz reduziert nicht nur den Bedarf an Messzeit und Probenmenge drastisch, er eröffnet auch die Möglichkeit, Viren mit Röntgenlasern zu analysieren“, fasst Meents zusammen. In einem nächsten Schritt planen die Wissenschaftler, die Kapazität ihres Chips von 22.500 auf rund 200.000 Mikroporen fast zu verzehnfachen und die Scangeschwindigkeit auf bis zu tausend Proben pro Sekunde weiter zu erhöhen. Dies würde es erlauben, die Möglichkeiten des europäischen Röntgenlasers European XFEL besser zu nutzen, der zurzeit in der Region Hamburg in Betrieb geht und bis zu 27.000 Röntgenblitze pro Sekunde erzeugen soll. Außerdem soll bei der nächsten Generation des Chips jeweils nur diejenige Mikropore freiliegen, die gerade untersucht wird, um die übrigen Kristalle vor Schäden durch Streustrahlung des Röntgenlasers zu schützen.
An der Untersuchung waren auch Forscher der Universität Oxford, der Universität von Ostfinnland, des schweizerischen Paul-Scherrer-Instituts, des Lawrence Berkeley National Laboratorys und von SLAC in den USA beteiligt. Forscher der Diamond Light Source haben bei dieser Entwicklung eng mit DESY-Wissenschaftlern zusammengearbeitet, wesentliche Teile der Entwicklung und Tests des mikrostrukturierten Chips haben an den Messstationen I02 und I24 bei Diamond stattgefunden.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Proteinanalytik
Die Proteinanalytik ermöglicht einen tiefen Einblick in diese komplexen Makromoleküle, ihre Struktur, Funktion und Wechselwirkungen. Sie ist unerlässlich für die Entdeckung und Entwicklung von Biopharmazeutika, das Verständnis von Krankheitsmechanismen und die Identifizierung von therapeutischen Zielen. Durch Techniken wie Massenspektrometrie, Western Blot und Immunoassays können Forscher Proteine auf molekularer Ebene charakterisieren, ihre Konzentration bestimmen und mögliche Modifikationen identifizieren.

Themenwelt Proteinanalytik
Die Proteinanalytik ermöglicht einen tiefen Einblick in diese komplexen Makromoleküle, ihre Struktur, Funktion und Wechselwirkungen. Sie ist unerlässlich für die Entdeckung und Entwicklung von Biopharmazeutika, das Verständnis von Krankheitsmechanismen und die Identifizierung von therapeutischen Zielen. Durch Techniken wie Massenspektrometrie, Western Blot und Immunoassays können Forscher Proteine auf molekularer Ebene charakterisieren, ihre Konzentration bestimmen und mögliche Modifikationen identifizieren.