Fresszellen im Gehirn: Gut oder böse?
Stärkung der Immunabwehr könnte den Ausbruch von Demenzerkrankungen möglicherweise hinauszögern
Welche Rolle spielen die Fresszellen des Gehirns, die Mikroglia, bei neurodegenerativen Erkrankungen? Schon lange beschäftigen sich Wissenschaftler mit dieser Frage. Ganz offensichtlich werden diese Zellen bei fast allen neurodegenerativen Demenzen aktiviert, aber warum? Haben sie eine Abwehraufgabe, indem sie die Eiweißablagerungen (Plaques), die typischerweise bei Alzheimer und ähnlichen Erkrankungen auftreten, „auffressen“ und totes Zellmaterial entfernen? Oder geben sie giftige Stoffe ab, die das Nervensystem letztendlich schädigen und damit für die fortschreitende Demenz verantwortlich sind?
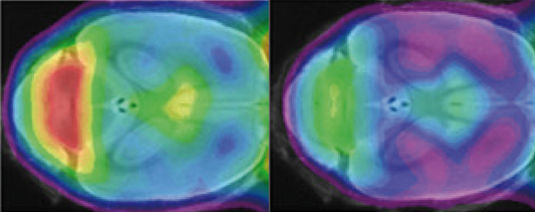
Nur ein kleiner Dreher im Erbgut: Bei Mäusen, die im sogenannten TREM2-Gen eine geringfügige Veränderung haben, ist die normale Aktivität (gelb-rot) der Fresszellen im Gehirn deutlich geringer (rechtes Bild).
Haass Lab
Ein interdisziplinäres Team von Zellbiologen, Nuklearmedizinern und Neuropathologen an der LMU und am Standort München des Deutschen Zentrums für Neurodegenerative Erkrankungen (DZNE) sind dieser Frage gemeinsam mit Kollegen von Roche in Basel nachgegangen. Die Wissenschaftler um Professor Christian Haass, Inhaber des Lehrstuhls für Stoffwechselbiochemie der LMU und Sprecher des DZNE-Standortes München, erforschten dabei die Funktion eines Gens mit der Bezeichnung „TREM2“, das im Gehirn ausschließlich in den Mikrogliazellen aktiv ist. Veränderungen in diesem Gen können den Ausbruch neurodegenerativer Erkrankungen wie Alzheimer, Parkinson und Frontotemporaler Demenz (FTD) verursachen.
Mithilfe der „Genschere“ CRISPR/Cas9 führten die Wissenschaftler eine winzige Veränderung – beim Menschen löst sie eine FTD-ähnliche Erkrankung aus – in das Erbgut von Mäusen ein. Der Austausch eines einzigen Bausteins hatte massive Konsequenzen. Denn das TREM2-Gen dient als Bauanleitung für ein Protein, dessen Eigenschaften sich aufgrund der eingeführten Genmutation veränderten. In früheren Arbeiten hatten die Wissenschaftler bereits herausgefunden, dass dieses Protein zur Zelloberfläche transportiert werden muss, um biologisch aktiv zu werden. Die eingeführte Mutation behindert jedoch dessen Transport, so dass nur noch sehr wenig davon an die Zelloberfläche gelangt. Dies führt zu einem massiven Funktionsverlust der Mikroglia, der sich in verschiedenster Weise äußert. So zeigt sich zum Beispiel, dass die genveränderten Mäuse ihre Mikroglia nicht mehr aktivieren. Das heißt: Die Zellen schlummern und ändern ihr Programm auch dann nicht, wenn es zu krankhaften Veränderungen im Gehirn kommt. Sie wandern daher nicht mehr zu den Stellen pathologischer Schädigungen: Plaques und tote Hirnzellen werden deshalb nicht mehr abgebaut. Überdies hat der Funktionsverlust fatale Folgen für den gesamten Energiehaushalt des Gehirns – es verbraucht deutlich weniger Zucker, ein unmissverständliches Zeichen für dessen Untergang. Gleichzeitig verringert sich auch die Durchblutung des gesamten Gehirns. Ähnliche Phänomene beobachtet man auch bei Menschen mit einer TREM2-Mutation.
Haass: „Unsere Forschungsergebnisse unterstreichen die Bedeutung der Mikroglia für die Gesundheit des Gehirns. Und sie deuten darauf hin, dass den Mikrogliazellen zumindest während des Ausbruches neurodegenerativer Erkrankungen eine Abwehrfunktion zukommt. Insofern hoffen wir, hier einen neuen Ansatz für die Therapieentwicklung gefunden zu haben: die Stärkung der Abwehrfunktion der Mikroglia. Diese Funktion durch Medikamente oder andere Maßnahmen zu unterstützen, könnte den Ausbruch von Demenzerkrankungen möglicherweise hinauszögern.“
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.