Wie Enzyme kommunizieren
Wissenschaftler erklären Mechanismus in Zellen, der elektrische in chemische Signale umwandelt
Die Enzyme Stickstoffmonoxid NO-Synthase (NOS1) und Proteinkinase C (PKC) spielen bei einer Vielzahl von Signalübertragungsprozessen in Nervenzellen des Gehirns wie auch in Zellen anderer Organe eine entscheidende Rolle. Die Wissenschaftlerinnen Dr. Cristina Constantin und Dr. Catrin Müller haben zusammen mit Prof. Dr. Bernd Fakler am Physiologischen Institut der Universität Freiburg erstmals gezeigt, dass sich die Enzyme unter physiologischen Bedingungen allein durch die elektrische Erregung an der Zellmembran aktivieren lassen. Durch direkte strukturelle Bindung der beiden Enzyme an spannungsgesteuerte Kalziumkanäle entstehen Proteinsuperkomplexe, die elektrische Signale an der Zellmembran mit hoher Geschwindigkeit und zielgerichtet in chemische Signalprozesse im Zellinneren umwandeln.
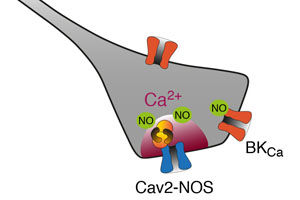
Elektro-chemische Kopplung durch Superkomplexe: Der Kalziumkanal (Cav2) liefert Kalziumionen (Ca2+), die das Enzym NO-Synthase (NOS) zur Herstellung des Botenstoffes NO aktivieren.
Grafik: Bernd Fakler
Die Arbeitsgruppe um Fakler zeigte in der Vergangenheit, dass die beiden kalziumabhängigen Enzyme NO-Synthase (NOS1) und Proteinkinase C (PKC) Bestandteile der Proteinumgebung bestimmter spannungsgesteuerter Kalziumkanäle (Cav2-Kanäle) im Gehirn sind. Bisher war jedoch nicht bekannt, wie die Enzyme mit den Kalziumkanälen kommunizieren. In seiner Arbeit hat das Forschungsteam bewiesen, dass die Enzyme hierzu einen Proteinsuperkomplex bilden. Darin sind NOS1 oder PKC und die Cav2-Kanäle strukturell miteinander vereinigt, was die beiden kalziumabhängigen Enzyme zum einem an der Innenseite der Zellmembran verankert und sie zum anderen in die unmittelbare Nähe der Kanalpore platziert. Wird die Zellmembran erregt, öffnen sich die Cav2-Kanäle und liefern Kalziumionen auf die Innenseite der Zellmembran, wo diese an die beiden Enzyme binden. Diese Bindung aktiviert die Enzyme, die dann entweder NO, einen frei beweglichen Botenstoff, erzeugen oder eine Phosphatgruppe auf zytoplasmatische Zielproteine übertragen.
Wegen des geringen Abstandes zwischen Kanalpore und Enzym reichen Erregungen der Zellmembran von weniger als einer Millisekunde aus, um eine zuverlässige Enzymaktivität auszulösen. Maximale Wirkung der elektro-chemischen Kopplung wird erzielt, wenn die Zellmembran nicht von einzelnen Impulsen erregt wird, sondern die Nervenzelle Salven mit einer Frequenz von einem Hertz und mehr feuert.
Die Cav2-Enzym-Superkomplexe garantieren aber nicht nur eine schnelle und zuverlässige elektro-chemische Koppelung. Sie sorgen auch dafür, dass die übertragenen Signale sehr lokal, also auf einen Bereich von wenigen Nanometern um die Cav2–Kanäle, begrenzt bleiben. Dadurch wird sichergestellt, dass die Enzyme nur die von ihnen initiierten zellulären Prozesse anstoßen, andere Kalzium-Signalwege, wie der gerichtete Zelltod, aber verhindert werden. Darüber hinaus haben die Experimente der Freiburger Forschenden einen Weg aufgezeigt, wie sich die Enzyme physiologisch aktivieren lassen. Dieser stellt eine Alternative zu den derzeit häufig benutzten künstlichen Aktivatoren, chemischen Stoffen wie den NO-Donoren oder den Diacylglyceriden, dar.
Originalveröffentlichung
Constantin, C.E., Müller, C.S., Leitner, M., Bildl, W., Schulte, U., Oliver, D., and Fakler, B. (2017). Identification of Cav2-PKC and Cav2-NOS1 complexes as entities for ultrafast electro-mechanical coupling. Proc Natl Acad Sci USA (in press).
Meistgelesene News
Originalveröffentlichung
Constantin, C.E., Müller, C.S., Leitner, M., Bildl, W., Schulte, U., Oliver, D., and Fakler, B. (2017). Identification of Cav2-PKC and Cav2-NOS1 complexes as entities for ultrafast electro-mechanical coupling. Proc Natl Acad Sci USA (in press).
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte

Wissenschaftler decken Zusammenhänge zwischen Spermienqualität und Handynutzung auf - Ergebnisse ihrer aktualisierten Meta-Analyse deuten auf die potenziellen Gefahren moderner elektronischer Geräte hin
Kristallstudie könnte DNA-Rätsel aufklären - Rice-Labor erfasst ungesehene Details der Replikation, Hinweise darauf, wie Mutationen entstehen können

TOYOPEARL® AF-rProtein L-650F | Chromatographie-Harze | Tosoh

Warum die europäische Kolonisierung den Blaubock zum Aussterben brachte - Internationales Wissenschaftsteam und Start-up Colossal Biosciences entschlüsseln die DNA des Blaubock mit Hilfe modernster Computeranalyse-Software
MHH: Wirksame Gentherapie für Kinder mit schwerer Immunkrankheit - Neues Therapieverfahren hilft weltweit zum ersten Mal Patienten mit der Erberkrankung Wiskott-Aldrich-Syndrom
Merck erhält zweites US-Patent für CRISPR-Technologie zur Genomeditierung - CRISPR-chrom-Technologie verbessert Zugänglichkeit des Genoms und sorgt für effizientere Editierung

Schneller Anstieg von Stickoxiden vergrößert Herzinfarktrisiko

Ein „Lineal" für Moleküle - Verfahren mit Graphen bietet zehnfach verbesserte optische Auflösung

Den Feind zum Freund machen - Klingt paradox: Das Varizella-Zoster-Virus breitet sich im Körper besser aus, indem es die Immunabwehr verstärkt
Die Anzahl der Biotechnologieunternehmen verzeichnete trotz Krise lediglich einen Rückgang um 10%

Giftiger Krebs aus Maya-Unterwasserhöhlen liefert neue Wirkstoffkandidaten