Ein unterschätztes Protein wird erhört
Gai3 steuert die Entwicklung der Hörfunktion
Ein bislang unterschätztes Protein trägt entscheidend dazu bei, ob wir in der Lage sind zu hören oder nicht. Wissenschaftler der Universität Tübingen und dem INSERM, Neurocentre Magendie, in Bordeaux sowie aus England und den USA konnten zeigen, dass das Protein G-alpha-i3 die Anordnung und Ausrichtung feiner Härchen im Innenohr steuert, die beim Menschen und vielen an Land lebenden Wirbeltieren für die Hörfähigkeit grundlegend sind. Damit zeigen sie einen neuen Ansatz auf, wie genetisch bedingte Schwerhörigkeit künftig behandelt werden könnte.
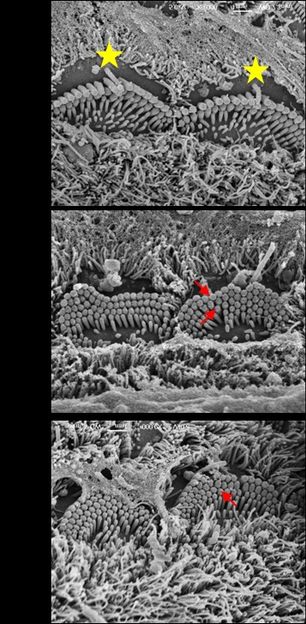
Elektronenmikroskopische Aufnahmen von inneren Haarzellen
Professor Andrew Forge, Ear Institute, UCL London
Im Zentrum der Wahrnehmung akustischer Signale steht die Umwandlung von Schallwellen in elektrische Nervenimpulse. Das ermöglichen die im Innenohr lokalisierten Haarzellen, die hierfür mit Bündeln von feinen Härchen, sogenannten Stereozilien, ausgestattet sind. Der Druck einer Schallwelle lenkt die Stereozilien der Haarzellen entlang der Hörschnecke aus, was zur Umwandlung der Bewegung in einen elektrischen Impuls führt. Um diese Funktion zu erfüllen, sind die Haarzellen bei Menschen und Tieren im Regelfall nach einem bestimmten System ausgerichtet und synchronisiert angeordnet. Die Wissenschaftler sprechen hier von „Polarität“. Störungen in der Architektur dieser sensorischen Haarzellen, ausgelöst etwa durch Gendefekte oder aber auch durch unerwünschte Nebenwirkungen von Arzneien, können zu Hörstörungen und Taubheit führen.
Welche molekularen Mechanismen für diese Anordnung der Haarzellen zuständig sind, versteht die Wissenschaft immer noch nicht vollständig. Aus früheren Untersuchungen war jedoch bekannt, dass die für Signalweiterleitungen im Körper zuständigen G-Proteine eine Rolle spielen könnten. Ein Regulator von G-Proteinen, der „G-protein signalling modulator 2“ (Gpsms2), gilt als wesentlich für die Polarität der Haarzellen im Innenohr. Dabei agiert Gpsms2 zusammen mit einem G-alpha-i-Protein. Da letzteres in drei verschiedenen nahezu identischen Varianten vorkommt, glaubte man, dass bei Funktionslosigkeit einer Variante die verbliebenen diese ersetzen können, um die Hörfähigkeit zu erhalten.
Die Teams von Dr. Mireille Montcouquiol (Bordeaux) und Professor Bernd Nürnberg (Tübingen) hatten bereits nachweisen können, dass nur eine Isoform, nämlich G-alpha-i3, die systematische Anordnung der Haarzellen sicherstellt (Ezan et al., Nature Cell Biology, 2013). Die jetzt publizierte Arbeit beschreibt, dass sowohl die Zahl und Länge als auch die Architektur der Stereozilienbündel auf den Haarzellen in der Hörschnecke durch G-alpha-i3 gesteuert wird. Bei Mäusen, denen G-alpha-i3 fehlt, sind die Zilien verkürzt und weisen eine unkoordinierte Anordnung auf (siehe Abbildung). Die Hörforscher Dr. Lukas Rüttiger und Lewis Lee im Team der Arbeitsgruppe von Professor Marlies Knipper am Hörforschungszentrum in Tübingen wiesen bei den Mäusen zudem Schwerhörigkeit nach.
Damit wurde nun erstmals gezeigt, dass nicht nur Gpsms2, sondern auch das bislang wenig beachtete und nur scheinbar ersetzbare G-alpha-i3 ein Kandidatengen für genetisch bedingte Schwerhörigkeit darstellt. Tatsächlich gibt es eine Reihe klinischer Berichte über Patienten mit G-alpha-i3-Gendefekten, die unter Schwerhörigkeit leiden. Ziel der weiteren Untersuchungen des Teams ist ein besseres molekulares Verständnis G-Protein-abhängiger Hörverluste, um neue pharmakologische Ansatzpunkte für die Behandlung dieser Formen der Schwerhörigkeit zu finden.