Durchbruch: FDA erteilt Zulassung für Avelumab
Erste Immuntherapie zur Behandlung von metastasiertem Merkelzellkarzinom
Merck und Pfizer haben bekannt gegeben, dass die US-amerikanische Zulassungsbehörde FDA (Food and Drug Administration) die Marktzulassung für BAVENCIO® (Avelumab) Injektion 20 mg/ml zur intravenösen Verabreichung für die Behandlung von Erwachsenen und Kindern ab 12 Jahren mit metastasiertem Merkelzellkarzinom (mMCC) erteilt hat. Diese Indikation wird im Rahmen der beschleunigten Zulassung auf Basis des Tumoransprechens und der Ansprechdauer zugelassen. Die Aufrechterhaltung der Zulassung in dieser Indikation kann vom Nachweis und der Beschreibung des klinischen Nutzens im Rahmen von konfirmatorischen Studien abhängig sein. BAVENCIO wird gemeinsam von EMD Serono, dem biopharmazeutischen Geschäft von Merck in den USA und Kanada, und Pfizer vertrieben werden. Das Präparat wurde im Rahmen von Zulassungsprogrammen der FDA mit Sonderstatus als Therapiedurchbruch („Breakthrough Therapy“) bzw. Prioritätsprüfung („Priority Review“) entwickelt, geprüft und zugelassen.
BAVENCIO, ein humaner Anti-PD-L1-Antikörper, ist die erste von der FDA zugelassene Therapie für Patienten mit mMCC. Das metastasierte MCC ist ein seltener, aggressiver Hautkrebs. Weniger als die Hälfte der betroffenen Patienten überleben länger als ein Jahr und weniger als 20 % länger als fünf Jahre.
„Das Herzstück dieser Zulassung durch die FDA ist unser Anspruch, für Patienten mit schwierig zu behandelnden Krebserkrankungen wie dem metastasierten Merkelzellkarzinom etwas Entscheidendes bewirken zu wollen“, sagte Belén Garijo, Mitglied der Geschäftsleitung von Merck und Leiterin des Unternehmensbereichs Healthcare. „Der Weg von BAVENCIO bis zur Zulassung beinhaltete Jahre der harten Arbeit - angefangen bei den Wissenschaftlern, die dieses Molekül in unseren Laboren entdeckten, über unsere Allianz mit Pfizer bis zu den Studienteilnehmern und Prüfärzten weltweit. Wir sind allen Beteiligten dankbar, die es uns ermöglicht haben, Patienten diese wichtige neue Behandlungsoption zugänglich zu machen.“
„Der heutige Tag ist ein wichtiger Meilenstein für alle Betroffenen in ihrem Kampf gegen das metastasierte Merkelzellkarzinom, für die es bisher neben der Chemotherapie keine weiteren Behandlungsoptionen gab“, sagte Albert Bourla, Group President von Pfizer Innovative Health. „Diese Zulassung untermauert die Stärke von Zusammenarbeit, wenn es darum geht, wichtige neue Behandlungsmöglichkeiten für Krebspatienten beschleunigt voranzutreiben.“
„Das Merkelzellkarzinom ist seltener als andere, besser bekannte Hautkrebsarten. Es ist jedoch ein sehr aggressiver Tumortyp und der Anteil der Betroffenen, die am MCC versterben, ist deutlich höher als bei Melanom-Patienten“, sagte Dr. Deborah S. Sarnoff, President der Skin Cancer Foundation. „Mit dieser Zulassung sehe ich neue Hoffnung für die Betroffenen und ihre Angehörigen, die sich den Herausforderungen dieses seltenen Hautkrebses stellen müssen.“
Die Wirksamkeit und Sicherheit von BAVENCIO wurden in der Studie JAVELIN Merkel 200 belegt. Diese offene, einarmige, multizentrische Studie wurde an 88 Patienten mit histologisch bestätigtem metastasiertem MCC durchgeführt, deren Erkrankung unter oder nach Chemotherapie zur Behandlung eines Erkrankungsstadiums mit Fernmetastasen fortgeschritten war. Bei 65 % der Patienten war eine Krebstherapie zur Behandlung von metastasiertem MCC vorausgegangen, bei 35 % zwei oder mehr Therapien. Als Hauptparameter für Wirksamkeit wurden die bestätigte Gesamtansprechrate (ORR) analog der Kriterien von RECIST (Response Evaluation Criteria in Solid Tumors) V1.1 gemäß Bewertung eines verblindeten unabhängigen zentralen Prüfausschusses (IRC) sowie die Ansprechdauer ebenfalls gemäß IRC-Bewertung herangezogen.
Die Gesamtansprechrate betrug 33 % (95 % Konfidenzintervall [CI]: 23,3 – 43,8 %). Bei 11 % der Patienten kam es zur Vollremission (95 % CI: 6,6 - 19,9 %) und bei 22 % zur Teilremission (95 % CI: 13,5 - 31,7 %). Mit einer Ansprechdauer von mindestens sechs Monaten in 86 % der Fälle (n = 25) und mindestens 12 Monaten bei 45 % (n = 13) war das Tumoransprechen dauerhaft. Die Ansprechdauer reichte von 2,8 Monaten bis über 23,3 Monate.
Die Warnhinweise und Vorsichtsmaßnahmen zu BAVENCIO beinhalten immunvermittelte Nebenwirkungen (wie Pneumonitis, Hepatitis, Kolitis, Endokrinopathien, Nephritis und Nierenfunktionsstörung sowie andere Nebenwirkungen), Infusionsreaktionen und Embryo-/Fetotoxizität. Zu den häufigsten Nebenwirkungen (bei mindestens 20 % der Patienten) gehörten Müdigkeit (50 %), Schmerzen der Skelettmuskulatur (32 %), Diarrhö (23 %), Übelkeit (22 %), Infusionsreaktionen (22 %), Hautausschlag (22 %), verminderter Appetit (20 %) und peripheres Ödem (20 %).1 Weitere Informationen entnehmen Sie bitte dem Abschnitt „Wichtige Sicherheitsinformationen“ für BAVENCIO weiter unten.
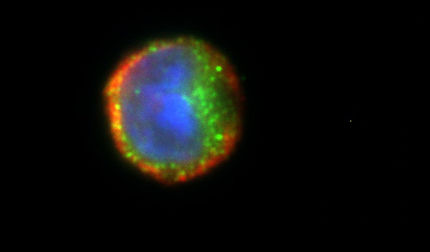
BAVENCIO ist so konzipiert, dass es potenziell sowohl das adaptive als auch das angeborene Immunsystem beteiligt. Durch die Bindung an PD-L1 soll BAVENCIO Tumorzellen davon abhalten, selbst PD-L1 als Schutz vor weißen Blutkörperchen wie z. B. T-Zellen zu nutzen, und sie dadurch den Anti-Tumor-Reaktionen der Immunzellen aussetzen. BAVENCIO führte in vitro nachweislich zu Antikörper-abhängiger zellulärer Zytotoxizität (ADCC).
BAVENCIO kann jetzt in den USA bestellt werden.