Doppel-Düse spart Protein-Kristalle
Neuartiges Konzept erweitert das Spektrum der Protein-Kristallographie
Eine neuartige Injektionsdüse reduziert den Verbrauch wertvoller Proteinkristalle in der Kristallographie und erweitert das Spektrum dieser weit verbreiteten Analysemethode. Durch das Konzept kommt die serielle Röntgenkristallographie, mit der sich die räumliche Struktur von Proteinen atomgenau bestimmen lässt, mit bis zu acht Mal weniger Kristallen aus, wie die Entwickler um DESY-Wissenschaftlerin Dr. Saša Bajt vom Center for Free-Electron Laser Science (CFEL) im Fachblatt „Scientific Reports“ berichten. Die Forscher haben mit Hilfe ihrer Düse unter anderem bislang unbekannte Details in der Struktur des Enzyms RNA-Polymerase II bestimmt.
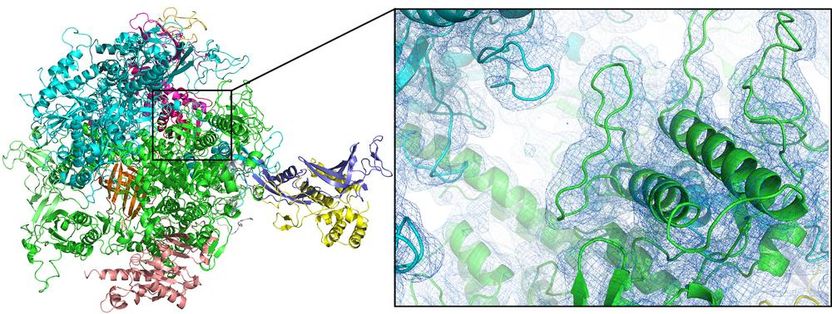
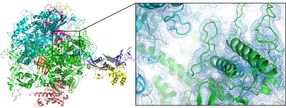
Die räumliche Struktur des Enzyms RNA-Polymerase II (hier als sogenannter Cartoon-Plot dargestellt) konnte mit Hilfe der neuartigen Düse erstmals bei Zimmertemperatur analysiert werden.
Dave Bushnell, Stanford University, und Dominik Oberthür, DESY

Das Röntgenbild der neuartigen Düse während des Betriebs zeigt den inneren Proteinstrom, der von Ethanol umschlossen ist.
Dominik Oberthür, DESY

Biologen interessieren sich für die räumliche Struktur von Proteinen, weil sie viel über die genaue Funktionsweise dieser Biomoleküle verrät. Diese Informationen ermöglichen nicht nur ein tieferes Verständnis biologischer Prozesse, sie können beispielsweise auch zur Entwicklung maßgeschneiderter Medikamente beitragen. Die Röntgenkristallographie ist das mit Abstand wichtigste Werkzeug für derartige Untersuchungen. Dafür wird aus den zu untersuchenden Proteinen ein kleiner Kristall gezüchtet und mit Röntgenstrahlung beleuchtet. Das Röntgenlicht wird am Kristallgitter gestreut und erzeugt ein charakteristisches Streubild, aus dem sich die räumliche Struktur des Kristalls und damit des Proteins selbst berechnen lässt.
Allerdings lassen sich viele Proteine nicht gern in Kristallform zwängen, weil dies ihrem natürlichen Zustand widerspricht. „Proteinkristalle zu züchten ist kompliziert, oft lassen sich nur wenige millionstel Gramm und extrem winzige Kristalle produzieren“, erläutert Dr. Dominik Oberthür von DESY, Hauptautor der wissenschaftlichen Veröffentlichung. Mit den extrem hellen Blitzen sogenannter Freie-Elektronen-Röntgenlaser (XFEL) lassen sich selbst solche winzigen Kristalle noch analysieren, aber in der Regel sind tausende Streubilder nötig, um die Proteinstruktur zu bestimmen. Da die empfindlichen Mikrokristalle jedoch im intensiven Röntgenblitz verdampfen, nachdem sie ihr Streubild erzeugt haben, sprüht man einen beständigen Strahl frischer Mikrokristalle durch den gepulsten Laser. Dieses Konzept nennt sich serielle Röntgenkristallographie und hat die Analyse zahlreicher zuvor nicht untersuchbarer Proteine ermöglicht.
Aber auch solche Mikrokristalle sind oft schwierig zu züchten. Zudem wird in der Regel nur ein kleiner Teil der Kristalle im Strahl tatsächlich von einem Röntgenblitz getroffen – je nach Geometrie des Kristallstrahls und den technischen Parametern des Röntgenlasers. „Je weniger Kristalle, je weniger Proteinmaterial man braucht, desto eher lässt sich die Analyse durchführen“, betont Oberthür. Bajts Team hat daher das neue Konzept einer sogenannten Double-Flow Focusing Nozzle (DFFN) entwickelt, also einer doppelt flüssigkeits-fokussierenden Düse, die den Verbrauch der Proteinkristalle deutlich reduziert. Üblicherweise werden die zu untersuchenden Proteinkristalle in einer Trägerflüssigkeit, dem sogenannten Puffer, durch eine Spezialdüse in den Röntgenlaser injiziert. Um einen dünnen Strahl zu formen, liegt die Düse in der Mitte eines schnellen Gasstroms, der die Trägerflüssigkeit beschleunigt. Für einen stabilen Strahl darf eine Mindestflussrate nicht unterschritten werden, dadurch tropft der größte Teil der Proteinkristalle in der Regel ungenutzt in einen Auffangbehälter und ist verschwendet.
In der neuen Doppeldüse wird der Strahl nun aus Ethanol (Alkohol) geformt. Erst in die Mitte dieses Ethanol-Jets wird ein extrem feiner Strahl mit Proteinkristallen injiziert. „Bislang musste der Puffer mit den Kristallen zwei Aufgaben erfüllen: Einen stabilen Strahl formen und die Proteinkristalle transportieren”, erläutert Juraj Knoška, CFEL-Doktorand der Universität Hamburg, der die Düse entwickelt hat. „Unser Ansatz trennt diese Aufgaben und nutzt jeweils die am besten geeigneten Flüssigkeiten dafür.“ Ethanol besitzt ideale Eigenschaften, um einen sehr stabilen Strahl zu bilden, in dessen Zentrum dann ein sehr feiner Strom mit Kristallen fließt. Auf diese Weise ließ sich die Flussrate des Puffers von 40 Mikrolitern (millionstel Litern) auf nur noch 2 Mikroliter pro Minute reduzieren. Darüber hinaus lässt sich der feine Strom mit Nanokristallen präzise mit dem dünnen Strahl des Röntgenlasers überlagern. Auf diese Weise verbessert sich nicht nur der Anteil der vom Röntgenlicht getroffenen Kristalle, sondern auch die Qualität der Streubilder.
„Wir reduzieren nicht nur den Kristallverbrauch, unsere doppelt fokussierende Düse nutzt die Röntgenquelle auch effizienter, indem wir die Rate erhöhen, mit der wir hochwertige Streubilder aufzeichnen“, sagt Bajt. „Außerdem ermöglicht das Ethanol als Jet-Flüssigkeit die Untersuchung von Proteinen, die Puffer benötigen, die sich bislang nicht injizieren lassen. Unser Konzept erweitert damit das Spektrum von Biomolekülen, die sich analysieren lassen.“ Bajts Team hat die neue Düse am Röntgenlaser LCLS des US-Teilchenbeschleunigerzentrums SLAC in Kalifornien getestet und sich dafür mit mehreren anderen Forschergruppen zusammengetan, um die Struktur verschiedener Proteine zu entschlüsseln.
„Zusammen mit der Gruppe von Nobelpreisträger Roger Kornberg von der Stanford-Universität konnten wir die Struktur des Enzyms RNA-Polymerase II erstmals bei Raumtemperatur entschlüsseln“, erläutert Oberthür. „Da die Strukturanalyse bei Raumtemperatur eine Voraussetzung für die Detailuntersuchung der Strukturdynamik ist, eröffnet das die Möglichkeit zeitaufgelöster Untersuchungen, sogenannter molekularer Filme, von diesem wichtigen System.“ Die Untersuchung zeigte einige bislang unbekannte Details in der Struktur dieses Enzyms. Mit Hilfe der Düse wurden noch zwei weitere Enzyme – eine membrangebundene Hydrogenase sowie eine Dioxygenase – sowie natürlich vorkommende Protein-Nanokristalle aus dem Kokon eines spezialisierten Virus (Cydia-pomonella-Granulovirus, CpGV) untersucht.
Die Düse löste dabei auch ein weiteres praktisches Problem dieser Form der Protein-Injektion: An der Kante gewöhnlicher Düsen und im Auffangbehälter unter dem Strahl sammeln sich in der Regel Proteinkristalle und Puffermaterial sowie Eiskristalle und wachsen zu tropfsteinartigen Gebilden heran. Wenn diese Protein-Eis-Stalagtiten und -Stalagmiten in den Röntgenstrahl geraten, machen sie nicht nur die Streubilder unbrauchbar, ihre Reflexionen können so hell sein, dass sie den Detektor beschädigen. Daher müssen derartige Experimente regelmäßig unterbrochen werden, um die Protein-Eis-Tropfsteine zu entfernen. „In unserer Düse verhindert das Ethanol die Entstehung solcher unerwünschten Gebilde und ermöglicht stundenlang stabile Experimentierbedingungen“, erläutert Oberthür.
„Die Düse hat in allen Experimenten extrem gut gearbeitet“, fasst Bajt zusammen. „Wir konnten die Zahl der nötigen Unterbrechungen in einer Schicht von zehn auf null reduzieren und erwarten, dass auch Experimentierstationen an anderen Röntgenlasern sowie an Synchrotron-Röntgenlichtquellen wie PETRA III bei DESY von den Vorteilen unseres Geräts profitieren können.“
An der Arbeit waren auch die Arizona State University, die Cornell University, die University of Minnesota, die Technische Universität Berlin, die Charité Universitätsmedizin Berlin, das Hauptman-Woodward Medical Research Institute, die Universität von Nova Gorica, das Institut für Metalle und Technologie in Ljubljana, das Helmholtz-Zentrum Geesthacht und das Hamburger Center for Ultrafast Imaging beteiligt. Das CFEL ist eine Kooperation von DESY, Universität Hamburg und Max-Planck-Gesellschaft.