Struktur einer altertümlichen biologischen Uhr enthüllt
Ein Team aus deutschen und niederländischen Wissenschaftlern hat unter der Leitung von Friedrich Förster und Albert Heck die Funktionsweise von einer der ältesten biologischen Uhren der Erdgeschichte in Cyanobakterien enthüllt. Cyanobakterien, auch ‚Blaualgen’ genannt, gehören zu den ältesten Organismen der Erde die durch Photosynthese Sauerstoff produzierten und bilden damit die Basis für das irdische Leben. Mit Hilfe modernster Methoden der molekularen Strukturanalyse gelang es den Forschern vom Max-Planck-Institut für Biochemie und der Universität Utrecht drei dieser ‚Uhr’-Proteine im Detail zu charakterisieren und ihr Zusammenspiel zu verstehen.
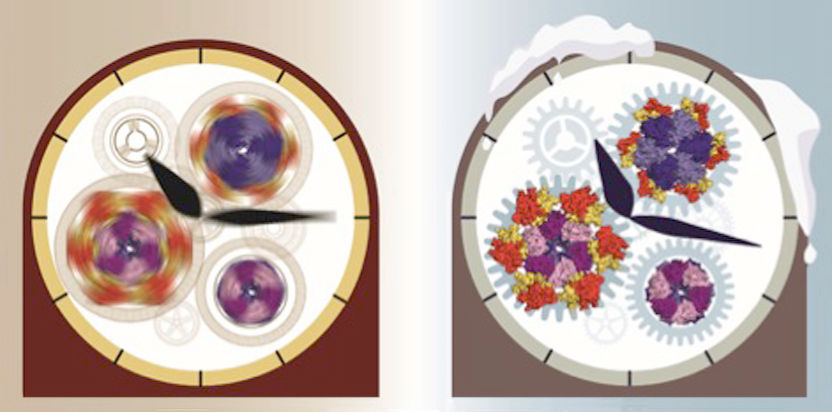
Die Uhr stoppen um den Mechanismus zu verstehen. Bei Raumtemperatur tickt die innere Uhr der Cyanobakterien stetig und die molekularen „Zahnräder“ drehen sich immer weiter. Dadurch ist es schwierig, den Mechanismus des Uhrwerks zu verstehen. Durch das abkühlen der Uhr konnten die Zahnräder gestoppt werden und Details über den Aufbau und das Zusammenspiel konnten aufgeklärt werden.
P. Lössl
Bereits seit zehn Jahren wissen wir, dass die biologische Uhr der Cyanobakterien aus nur drei Proteinbestandteilen KaiA, KaiB und KaiC aufgebaut ist. Diese Proteine bilden die Grundbausteine eines präzisen Uhrwerks und entsprechen damit den Zahnrädern, den Federn und dem Schwungrad einer mechanischen Uhr. Wird diesem System Energie zugeführt - ähnlich dem Aufziehen einer Uhr ‒ bilden diese drei Proteine, ohne weitere äußere Einwirkung, den Tag-Nacht-Rhythmus nach. Im Reagenzglas ist ein solch isoliertes System über Wochen stabil. Bereits 2005 beschrieben japanische Wissenschaftler dieses Phänomen, jedoch war bis heute unklar wie diese drei ‚Uhr’-Proteine dies zusammen tatsächlich bewerkstelligen.
In der aktuellen Studie nahmen sich nun die Wissenschaftler vom Max-Planck-Institut für Biochemie und der Universität Utrecht der Aufklärung dieser Aufgabe an. Dafür setzten sie modernste Methoden der molekularen Strukturanalyse ein, wie die der nativen Massenspektrometrie und der Kryo-Elektronenmikroskopie.
William Faulkner
Doch wie konnten die Wissenschaftler jetzt die Funktion der einzelnen Teile aufklären? "Um das ticken der biologischen Uhr in Cyanobakterien zu verstehen, haben wir im übertragenen Sinne die Zeit gestoppt", erklärt der Forschungsleiter Heck aus Utrecht. "Oder wie William Faulkner, Nobelpreisträger für Literatur einst sagte: 'Nur wenn die Uhr anhält, kommt die Zeit ins Leben.' Faulkner sprach vom Innehalten in der ständigen Hast des Lebens. Das war auch bei uns der Trick. Wir haben die biologische Uhr gestoppt indem wir sie eine Woche lang in den Kühlschrank gelegt haben. Im sprichwörtlichen Sinne haben wir die Zeit eingefroren.“
Hereingezoomt
Die molekularen Strukturen dieser ‚eingefrorenen’ Uhr konnten die Forscher mit Hilfe der Kryo-Elektronenmikroskopie im Detail untersuchen. So gelang es die Position dieser ‚Uhr’-Proteine im Uhrwerk zu bestimmen und zu verstehen, wie die einzelnen Komponenten - der Antrieb, die Feder und das Schwungrad ‒ dieser biologischen Uhr zusammenarbeiten. Die native Massenspektrometrie ermöglichte es dahingegen, die Häufigkeit des komplexen Ab- und Aufbaus dieser drei Proteine KaiA, KaiB und KaiC während eines 24-Stunden Zyklus aufzuklären und die rhythmusgebenden Proteinkomponenten zu bestimmen.
„Obwohl die biologische Uhr der Cyanobakterien erdgeschichtlich sehr alt ist können wir auch heute aus diesem System viel lernen“, so Heck. Vor wenigen Jahren entdeckten Forscher einen ähnlichen Mechanismus in unseren roten Blutzellen. „Cyanobakterien waren die ersten Sauerstoff produzierenden Organismen und haben damit die Grundlage für unser heutiges Leben geschaffen. Die Erkenntnisse dieser Studie bieten neue Einblicke in die biologischen ‚U(h)r’-Mechanismen des Lebens und bestimmte Aspekte können wir direkt in der klinischen Forschung weiter verfolgen“, fasst Heck zusammen.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Massenspektrometrie
Die Massenspektrometrie ermöglicht es uns, Moleküle aufzuspüren, zu identifizieren und ihre Struktur zu enthüllen. Ob in der Chemie, Biochemie oder Forensik – Massenspektrometrie eröffnet uns ungeahnte Einblicke in die Zusammensetzung unserer Welt. Tauchen Sie ein in die faszinierende Welt der Massenspektrometrie!
Themenwelt Massenspektrometrie
Die Massenspektrometrie ermöglicht es uns, Moleküle aufzuspüren, zu identifizieren und ihre Struktur zu enthüllen. Ob in der Chemie, Biochemie oder Forensik – Massenspektrometrie eröffnet uns ungeahnte Einblicke in die Zusammensetzung unserer Welt. Tauchen Sie ein in die faszinierende Welt der Massenspektrometrie!