Ein goldenes Ticket für eine schnellere Muskelregeneration
Goldnanopartikel mit Zytokinen reduzieren Entzündungen und fördern Regeneration der Muskelfasern
Jeder, der jemals einen Muskel gerissen oder verletzt hat, weiß, dass Schwellungen, Rötungen und Schmerzen bald auf die Verletzung folgen: klassische Anzeichen einer Entzündung. Entzündungen sind die natürliche Reaktion des Körpers auf die Förderung der Heilung, aber eine anhaltende, übermäßige Entzündung in den Muskeln kann zum Fortschreiten chronischer Krankheiten wie der Duchenne-Muskeldystrophie beitragen und kann die Zustände in anderen Teilen des Körpers wie rheumatoide Arthritis, Asthma und Diabetes verschlimmern. Ein natürlich vorkommendes entzündungshemmendes Zytokin namens IL-4 wird als Behandlung für solche Erkrankungen untersucht, aber seine Anwendung ist begrenzt, da es schnell im Körper zerfällt und in einer großen Dosis über wiederholte Infusionen verabreicht werden muss, was unerwünschte systemische Nebenwirkungen verursacht.
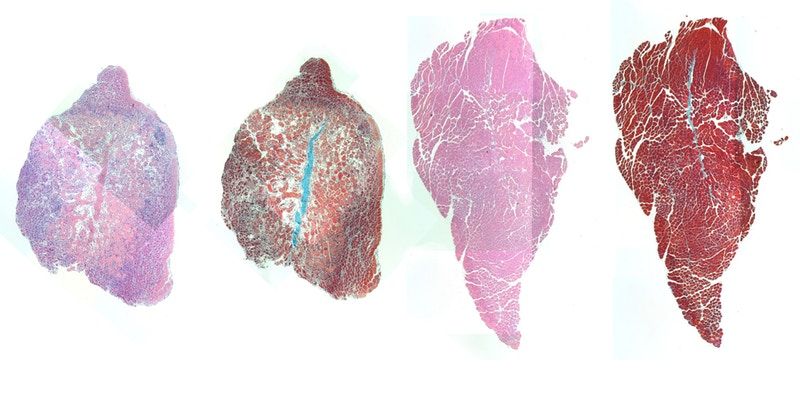
Färbungen für zelluläre Komponenten (rosa) und Muskelfasern (rot) im Mausmuskel, die mit IL-4-Nanopartikeln injiziert wurden, zeigen, dass ein behandelter Muskel (rechts) eine bessere Regeneration der Muskelzellen und weniger Leerraum im Muskelgewebe (weiß) aufweist als ein Muskel, der nicht behandelt wurde (links).
Wyss Institute at Harvard University
Nun verbessert eine neue Technik vom Wyss Institute an der Harvard University und der John A. Paulson School of Engineering and Applied Sciences (SEAS) in Harvard, bei der viele Kopien von IL-4 auf Goldnanopartikel angebracht und direkt in einen verletzten Muskel bei Mäusen injiziert werden, die Muskelstruktur und -stärke zwei Wochen nach der Verletzung.
"Durch die Nutzung der Entzündungsreaktion kann diese Technologie die therapeutischen und funktionellen Ergebnisse bestehender Behandlungen, die sich auf die direkte Regeneration der Muskulatur konzentrieren, signifikant verbessern", sagt Theresa Raimondo, eine Doktorandin am Wyss Institute und SEAS, die der erste Autor der Forschungsarbeit ist.
Das von Raimondo entwickelte System wirkt vor allem auf Makrophagen - eine Art Immunzelle, die als Reaktion auf Verletzungen oder Infektionen entsteht. Wenn sie am Ort des Angriffs auf den Körper ankommen, befinden sich die Makrophagen in einem entzündungsfördernden Zustand namens M1, der die Freisetzung von entzündlichen Zytokinen, antimikrobiellen Peptiden und anderen Molekülen fördert, die die Immunantwort auslösen und die Bildung neuer Muskelzellen fördern. Dann wechseln die Makrophagen in den M2-Zustand, was die Entzündung reduziert und die Reifung der Muskelfasern fördert.
Wenn das Gleichgewicht der M1- und M2-Zustand-Makrophagen gestört ist und zu viele M1-Makrophagen an der Verletzungsstelle vorhanden sind, wird die Muskelreparatur gehemmt. IL-4 kann dazu führen, dass Makrophagen von M1 auf M2 wechseln und so die Muskelfasern schneller heilen; jedoch hat es sich als schwierig erwiesen, IL-4 an seinem Zielort anzureichern, und frühere Formulierungen, die versucht haben, dieses Problem zu lösen, haben keine signifikanten Verbesserungen in Modellen von Entzündungen oder Verletzungen gezeigt.
Raimondo und Dr. David Mooney, Mitglied der Wyss Founding Core Faculty, nahmen diese Herausforderung an, indem sie IL-4 an Nanopartikeln aus Gold anhefteten, von denen einige Formulierungen von der FDA für therapeutische Anwendungen zugelassen sind. Sie testeten zunächst die IL-4-Nanopartikel gegen freischwebend IL-4 in lebenden menschlichen Zellen und fanden heraus, dass das an Nanopartikel gebundene IL-4 nicht nur seine biologische Funktion aufrechterhielt, sondern zu einem größeren Anteil an M2-Makrophagen führte als das ungebundene IL-4.
Anschließend testeten die Wissenschaftler ihr System in vivo, indem sie die IL-4-Nanopartikel drei Tage nach der Verletzung in die Beine von Mäusen mit verletzten Schienbeinmuskeln injizierten. Die Nanopartikel halfen, IL-4 im verletzten Muskel zu halten, anstatt in den Blutkreislauf und benachbarte Gewebe zu diffundieren, und Mäuse, die die Injektion erhielten, zeigten nach fünfzehn Tagen eine signifikante Zunahme der Muskelfaserfläche als Mäuse, die mit Nanopartikeln behandelt wurden, denen IL-4 fehlte. Zusätzlich konnten sich die mit IL-4 Nanopartikeln behandelten Muskeln mit deutlich mehr Kraft und Geschwindigkeit zusammenziehen als die mit freischwebendem IL-4 injizierten Muskeln.
Schließlich verdoppelte IL-4 Nanopartikel-Injektion den Prozentsatz der M2-Makrophagen und reduzierte die Anzahl der M1-Makrophagen im Vergleich zu Muskeln, die keine IL-4-Nanopartikel erhielten. Muskeln, die mit freiem IL-4 injiziert wurden, zeigten ebenfalls eine Reduktion der M1-Makrophagen, verursachten aber keinen Anstieg der M2-Makrophagen, was zeigt, dass die Konjugation von IL-4 mit Goldnanopartikeln den Übergang zu einem entzündungshemmenden Zustand verbessert und die Muskelregeneration fördert.
"Diese Arbeit zeigt, dass die Modulation der Entzündungsreaktion eine potente Methode zur Förderung der Regeneration von funktionellem Gewebe ist und dass IL-4-Nanopartikel den M2-Makrophagen-Phänotyp im Zusammenhang mit Verletzungen in vivo fördern können, was die Tür zu vielen spannenden Forschungsrichtungen öffnet", sagt Mooney, der auch der Robert P. Pinkas Family Professor für Bioengineering am SEAS ist.
Raimondo erforscht derzeit den Einsatz von IL-4-Nanopartikeln zur Behandlung der Duchenne-Muskeldystrophie bei Mäusen, verfeinert das Design der Nanopartikel und optimiert das Behandlungsschema. "Diese Experimente werden hoffentlich zeigen, dass IL-4-Nanopartikel den Makrophagen-Phänotyp im Kontext einer chronischen Entzündung verschieben können, zusätzlich zu den in dieser Arbeit untersuchten akuten Verletzungen, sagte Raimondo. Zukünftige Experimente werden auch die direkte Interaktion zwischen IL-4-Nanopartikeln und muskelerzeugenden Zellen sowie die Rolle des Makrophagen-Phänotyps bei der Muskelregeneration im Rahmen der Muskeldystrophie mit in vitro Modellen untersuchen.
"Am Wyss Institute suchen wir immer nach einer besseren Möglichkeit, die Dinge zu tun - "gut genug" ist nicht akzeptabel", sagte Dr. Donald Ingber, Gründungsdirektor von Wyss, der auch der Judah Folkman Professor für Gefäßbiologie an der HMS und das Vascular Biology Program am Boston Children's Hospital und Professor für Bioengineering an SEAS ist. "Diese Arbeit stellt nicht nur eine bessere Methode dar, um IL-4 an entzündetes Gewebe abzugeben, sondern bietet auch die Möglichkeit einer wirksameren Behandlung chronischer Entzündungskrankheiten, die in Zukunft viele Leben verbessern könnten."