Grüne Chemie aus dem Muschelfuß
Von der Miesmuschel kann sich die Chemieindustrie einiges abschauen. Nicht nur, dass ihr Perlmutt und die reißfesten Fäden, mit denen sie sich am Meeresboden festhält, außergewöhnliche Qualitäten besitzen. Wie sie diese Materialien erzeugt, könnte auch zur Blaupause für eine umweltfreundliche Produktion von komplex gebauten Polymerstrukturen werden. Wissenschaftler des Max-Planck-Instituts für Kolloid- und Grenzflächenforschung haben nun erstmals Einsichten gewonnen, wie die Byssusfäden im Fuß des Schalentiers entstehen. Zahlreiche Schritte dieser Bioproduktion laufen demnach selbstorganisiert ab, also ohne dass die Muschel eingreift. Diese Erkenntnis könnte einen Weg weisen, wie sich Polymere auch technisch auf einfache Weise zu größeren Strukturen anordnen lassen.

Ein Vorbild für Chemiker: Die feinen Byssusfäden, die Muscheln in ihrem zungenförmigen Fuß, haften unter Wasser besser als jeder Klebstoff aus der Tube. Sie sind reißfest, dehnbar, hart und selbstheilend. Außerdem bilden sie sich teilweise selbstorganisiert. Das könnte sich in der Technik nachahmen lassen, um Kunststoffe umweltfreundlich zu produzieren.
© MPI für Kolloid- und Grenzflächenforschung
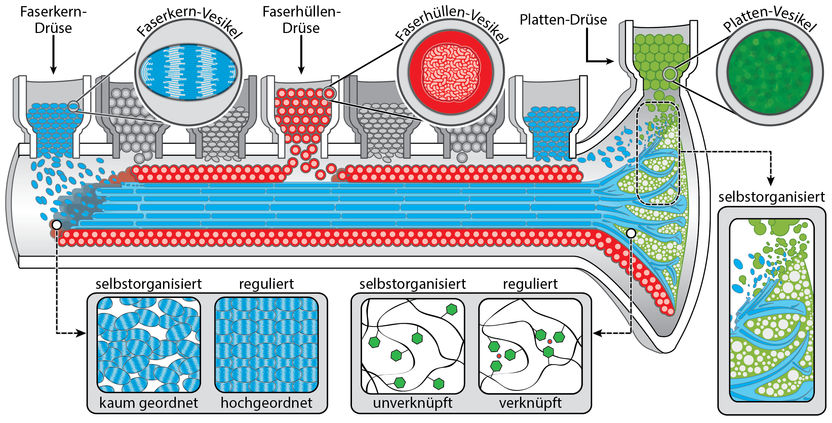
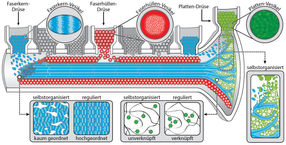
Grüne Chemieproduktion am Meeresgrund: Byssusfäden entstehen in einer feinen Rinne im Muschelfuß, die Platte am Ende des Fadens, die am Meeresboden haftet entsteht in einer Vertiefung am Ende der Rinne. Für den Faserkern (blau), die Faserhülle (rot) und die Platte (gün) gibt es dabei jeweils eigene Drüsen, die die entsprechenden Komponenten in Vesikeln freisetzen. Einige Schritte der Biopolymerisierung erfolgen selbstorganisiert, bei anderen greift die Muschel regulierend ein. So ordnen sich die Polymere des Kerns in kurzen Abschnitten von selbst parallel an, um sie über die ganze Länge des Fadens gleich auszurichten, muss die Muschel aktiv werden. Zudem vernetzen sich die Proteine in der Haut nicht von selbst, hier fügt das Meerestier nachträglich die Metallionen ein, die Verknüpfungen zwischen den Proteinsträngen schaffen und so nicht zuletzt die Selbstheilungskräfte der Fäden schaffen. Dagegen bildet sich die komplexe Struktur, in der die Platte des Fadens mit dessen Kern verbunden wird, die ähnlich aussieht wie Pflanzen im Boden wurzeln, selbstorganisiert.
© MPI für Kolloid- und Grenzflächenforschung

In der Fischtheke bekommt man sie nicht zu sehen, aber wenn Muscheln frisch vom Meeresgrund kommen, hängen ihre Byssusfäden manchmal noch an ihnen – als gelbliches haariges Gespinst. So unscheinbar sie aussehen, so sehr beeindrucken die Eigenschaften des Byssus zumindest Materialwissenschaftler. Und das gilt für alle drei Teile, die sich in einem Byssusfaden unterscheiden lassen: Die kleine Platte am Ende des Fadens, mit der sich eine Muschel an einen Stein auf dem Meeresboden heftet, klebt unter Wasser besser als jedes andere Material. Das Biopolymer, das den Kern der Faser bildet, ist sehr reißfest und heilt zudem von selbst, wenn es dennoch mal beschädigt wird. Und die Hülle der Fäden ist hart wie das Epoxidharz, aus dem etwa Leiterplatinen hergestellt werden, und dennoch dehnbar. Diese Qualitäten sind schon Grund genug, dass Chemiker versuchen die Materialien, die das Schalentier erzeugt, zu imitieren.
Wie sich jetzt herausstellt, könnte aber auch die Bioproduktion der Fäden Chemiker inspirieren: „Viele Ausgangsstoffe der Biopolymere formieren sich ganz von selbst zu der komplexen Struktur, einfach weil die Muschel sie an bestimmten Stellen und zeitlich aufeinander abgestimmt freisetzt“, sagt Matt Harrington, dessen Forschungsgruppe am Max-Planck-Institut für Kolloid- und Grenzflächenforschung nun erste Erkenntnisse über die Polymerfabrik des Meerestieres gewonnen hat.
Entscheidend ist, dass es für jeden Teil des Fadens eigene Drüsen gibt
Wie Forscher bereits seit längerem wissen, spinnt die Muschel die Byssusfäden in einer feinen Rinne in ihrem Fuß, und zwar indem Drüsen die Ausgangsstoffe in diese Vertiefung fließen lassen. Wie Matt Harrington und seine Mitarbeiter aber erst jetzt herausgefunden haben, sind die Drüsen jeweils einem Teil des Byssusfadens zugeordnet: Es gibt also solche für die Platte am Ende eines Fadens, seinen Kern und seine Haut. In der befinden sich die jeweils passenden Mischungen der Ausgangsstoffe, und zwar in Vesikeln, kleinen Bläschen. Die Differenzierung der Drüsen nach den drei Teilen eines Byssusfadens, ihre Position und der Zeitpunkt, zu dem sie ihre Vesikel freisetzen, sind entscheidend, damit die drei Teile der Faser dort entstehen, wo sie hingehören. So fließen genau aufeinander abgestimmt an verschiedenen Stellen die Vesikel mit den Komponenten für die Polymere des Kerns, der Haut und des Bodenplättchens in die Rinne und ordnen sich dort zu einem Material mit komplexer Struktur.
Das hat das Potsdamer Team beobachtet, indem sie die Drüsen im Muschelfuß künstlich zur Abgabe der Vesikel anregten, den Fuß aber ansonsten lähmten, um ihn untersuchen zu können. Dann froren sie mehrere Füße in verschiedenen Phasen der Bioproduktion der Fäden ein und analysierten sie scheibchenweise mit einer spektroskopischen Methode, die ihnen etwas über die chemische Zusammensetzung der Stoffe verriet. Die Ergebnisse dieser Analysen verglichen sie mit den Resultaten von Experimenten, in denen sie verschiedene chemische Bestandteile der Fasern unterschiedlich einfärbten.
„Da in dem gelähmten Fuß nur die Drüsen funktionierten, konnten wir genau unterscheiden, welche Schritte der Biopolymerisation selbstorganisiert stattfinden, und wo die Muschel noch regulierend eingreift“, erklärt Tobias Priemel, der an den Untersuchungen maßgeblich beteiligt war. Beim Kern des Byssusfadens war die unterschiedliche Wirkung von selbstorganisierten und biologisch regulierten Schritten besonders augenfällig. Die künstlich gesponnene Faser kam nämlich ziemlich unförmig aus der Rinne des Fußes. Wie die Forscher bei einem Blick auf ihre innere Struktur feststellten, hatten sich die Polymere des Kerns in ihren Experimenten auch nur über kurze Strecken akkurat parallel nebeneinander angeordnet und nicht über die gesamte Länge der Faser, so wie sie es in den natürlich erzeugten Fäden tun. „Möglicherweise formt der Muschelfuß den Faden, damit sich die Polymere über dessen ganze Länge parallel ausrichten“, so Tobias Priemel.
Auch in der Technik könnten Polymere selbstorganisiert entstehen
Auch die anderen Teile des Byssusfadens wiesen noch das ein oder andere Defizit auf, wenn die Herstellung des Fadens künstlich eingeleitet wurde, und die Muschel dabei nicht eingreifen konnte. Wie sie das tut, damit der Faden ohne diese Fehler entsteht, und warum sie bei anderen Schritten ihrer Byssusproduktion nicht aktiv werden muss, wollen Matt Harrington und seine Mitarbeiter nun aufklären. „Wenn wir wissen, welche Faktoren wichtig sind, damit sich die Biopolymere selbstorganisiert ordnen, können wir komplexe Polymere in der Technik vielleicht auf ähnliche Weise erzeugen“, sagt der Forscher. So könnte etwa der pH-Wert in den Vesikeln und in der Umgebung bei der Selbstorganisation im Muschelfuß eine Rolle spielen.
„Genauso interessant ist es aber, mehr über die biologische Regulation zu erfahren“, sagt Harrington. Denn das können ganz einfache Mechanismen sein, etwa dass der Fuß die Biopolymere in die gewünschte Form drückt oder dass die Muschel nachträglich Metallionen abgibt, damit sich die Proteine vernetzen. Auch solche Kniffe ließen sich bei der technischen Synthese von Polymeren leicht nachahmen. „Mein Traum ist es, mithilfe der Erkenntnisse, die wir an den Byssusfäden gewinnen, einmal in einem umweltfreundlichen Verfahren selbstheilende Materialien herzustellen, die auch ähnliche mechanische Eigenschaften haben wie die Byssusfäden“, so Harrington.
Originalveröffentlichung
Tobias Priemel, Elena Degtyar, Mason N. Dean und Matthew J. Harrington; "Rapid self-assembly of complex biomolecular architectures during mussel byssus biofabrication"; Nature Comm; 2017