Allgegenwärtig und einflussreich
Wissenschaftler der Universität Würzburg haben neue Details der Funktionsweise des Proteins Ubiquitin entschlüsselt. Diese bieten sich möglicherweise als Angriffspunkt für eine Therapie gegen Krebs an.
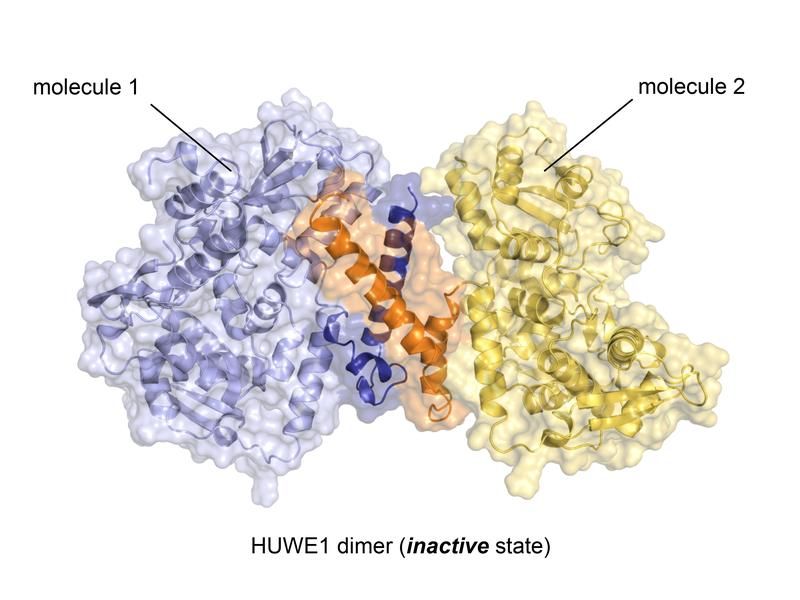
Kristallstuktur der Ubiquitin-Ligase HUWE1 im neu entdeckten inaktiven Zustand. Die die Komplexbildung vermittelnde Region ist farblich hervorgehoben (orange, dunkelblau).
Sonja Lorenz
Das Protein Ubiquitin steuert im menschlichen Körper eine Vielzahl physiologischer und pathophysiologischer Vorgänge. Es macht damit seinem Namen als ubiquitär = allgegenwärtig bedeutsamer zellulärer Regulator buchstäblich alle Ehre. Die Frage, wie Ubiquitin seine vielfältigen Funktionen ausführt, steht im Zentrum intensiver Forschungsbemühungen weltweit und bildet die Grundlage dafür, das Ubiquitin-System für therapeutische Anwendungen besser zugänglich zu machen. Würzburger Wissenschaftler sind diesem Ziel jetzt einen Schritt näher gekommen. Sie haben dafür ihr Augenmerk auf eine bestimmte Ubiquitin-Ligase gerichtet.
Enzyme bestimmen das Schicksal
„Ubiquitin-Ligasen sind Enzyme, welche das kleine Protein Ubiquitin an zelluläre Zielproteine heften und damit das Schicksal dieser Zielproteine lenken“, erklärt Dr. Sonja Lorenz, verantwortlicher Autor der Studie. Ähnlich einer „molekularen Postleitzahl“ könne Ubiquitin Zielproteine zu bestimmten Orten in der Zelle leiten oder veranlassen, dass sie spezifische Aufgaben übernehmen, Signale übertragen, in höhermolekulare Komplexe eingebaut oder zerstört werden.
Sonja Lorenz forscht am Rudolf-Virchow-Zentrum für Experimentelle Biomedizin der Universität Würzburg. Mit ihrem Team und Kollegen hat sie die Ubiquitin-Ligase HUWE1 genauer untersucht und neue Details seiner Funktionsweise entschlüsselt. HUWE1 hat wichtige Funktionen in der Entstehung verschiedener Krebsarten und wird daher als vielversprechender, bisher jedoch noch nicht genutzter Angriffspunkt für therapeutische Strategien angesehen.
Divide et impera: Ein Proteinriese wird zerteilt
Aus nahezu 4.400 Aminosäuren bestehend, ist HUWE1 ist ein extrem großes Protein, dessen dreidimensionale Struktur weitgehend unerschlossen ist. „Die enorme Größe von HUWE1, verbunden mit seiner strukturellen Flexibilität stellen eine erhebliche Herausforderung für den Strukturbiologen dar“, sagt Sonja Lorenz. Um sich dem Proteinriesen experimentell zu nähern, bedienten sich die Würzburger Wissenschaftler daher zunächst der altrömischen Strategie „divide et impera – teile und herrsche“ und bestimmten die atomare Struktur eines Fragments von HUWE1 mithilfe der Röntgenkristallographie.
Diese Struktur brachte eine bisher unbekannte, aber ungemein bedeutsame Eigenschaft von HUWE1 zum Vorschein: Zwei HUWE1-Moleküle können sich zu einem Komplex, einem sogenannten Dimer, zusammenlagern und ihre enzymatische Aktivität auf diese Weise selbst abschalten.
Folgenreiche Störungen im Gleichgewicht
Wie aber wird der Zusammenschluss zweier HUWE1-Moleküle in der Zelle verhindert, wenn HUWE1 aktiv sein soll? Auch auf diese Frage fand das Würzburger Forscherteam eine Antwort: „HUWE1 liegt in einem dynamischen Gleichgewicht aus der inaktiven Dimer-Form und aktiven Einzelmolekülen vor. Verschiedene zelluläre Faktoren können dieses Gleichgewicht regulieren“, erklärt Sonja Lorenz.
Einer dieser Faktoren ist der Tumorsuppressor p14ARF, welcher HUWE1 hemmt, in Krebszellen jedoch oftmals fehlt. Die neue Würzburger Studie beschreibt erstmals auf molekularer Ebene, wie die Hemmung von HUWE1 durch p14ARF zustande kommt. „Der Einfluss von p14ARF auf die Struktur und Aktivität von HUWE1 ist unglaublich spannend und bietet eine Reihe von Möglichkeiten, die Aktivität von HUWE1 gezielt zu beeinflussen, welche wir nun angehen möchten“, sagt Sonja Lorenz.