Wissenschaftler entdecken neue Details zur molekularen Proteinsortierung in der Zelle
Der gezielte Einbau von Proteinen in die Membran ist ein lebenswichtiger Prozess für den Erhalt der Zelle, da diese Proteine den Stoffaustausch und die Kommunikation mit der Umwelt sowie die Energieversorgung der Zelle sicherstellen. Proteinsortierungsmechanismen sorgen dafür, dass diese so genannten Membranproteine unter Tausenden verschiedener Proteine erkannt und zur Membran geleitet werden. Ein Team um Kärt Denks, Doktorandin in der Arbeitsgruppe von Prof. Dr. Hans-Georg Koch am Institut für Biochemie und Molekularbiologie der Universität Freiburg, hat in der Fachzeitschrift „Nature Microbiology“ am Beispiel des Darmbakteriums Escherichia coli den molekularen Mechanismus dieser Erkennung näher bestimmt. Die Forscher haben belegt: Das in allen Lebewesen vorkommende Signal recognition particle (SRP) identifiziert Proteine schon, während diese erst entstehen.
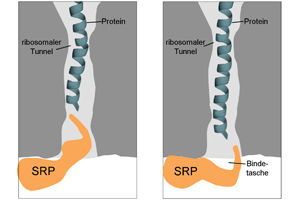
Der Proteinsortierungskomplex SRP tastet den ribosomalen Tunnel ab, in dem Proteine synthetisiert werden. Erkennt SRP ein geeignetes Protein, positioniert es seine Bindetasche am Tunnelausgang. Dort bindet der Komplex an das Protein und transportiert es zu seinem Bestimmungsort.
AG Koch
Die Synthese von Proteinen erfolgt in Ribosomen, Funktionseinheiten der Zelle, die die Proteine während der Synthese durch einen Tunnel in das Zellinnere leiten. Die Sortierung folgt einem Schema: Zu transportierende Proteine enthalten eine Aminosäureabfolge, die als Erkennungssignal dient und durch Sortierungskomplexe identifiziert wird. SRP, einer dieser Komplexe, kommt in Bakterien sowie in Lebewesen mit kernhaltigen Zellen vor und ist für die Erkennung von Membranproteinen verantwortlich. Aus früheren Untersuchungen war bekannt, dass SRP Membranproteine schon während der Synthese erkennt. Allerdings war der genaue Zeitpunkt umstritten. Zunächst wurde angenommen, dass die Signalsequenz vollständig aus dem ribosomalen Proteintunnel hervorgetreten sein muss, um erkannt werden zu können. Spätere Untersuchungen deuteten dagegen darauf hin, dass eine Identifizierung durch SRP bereits erfolgt, lange bevor die Signalsequenz das Ribosom verlässt – was die Ergebnisse aus Freiburg bestätigen.
Bei ihren Untersuchungen setzten die Forscher eine Technik ein, mit der sie Kontakte zwischen dem Ribosom und SRP bis zur Stufe einzelner Aminosäuren, den Bausteinen der Proteine, aufklären konnten. Das Team zeigte, dass SRP den ribosomalen Proteintunnel abtastet, um mögliche Proteine, an die es binden kann, zu erfassen. Wenn es ein geeignetes Protein erkennt, zieht es sich zum Ausgang des Tunnels zurück und positioniert dort seine Bindetasche, um das Membranprotein stabil binden zu können. Sobald dies erfolgt ist, leitet SRP die Zielsteuerung ein: Es bringt das synthetisierende Ribosom zur Membran, wo dieses an Transportkanäle bindet, um das Protein in der Membran zu verankern. Unterbleibt die frühe Erkennung durch SRP, etwa weil Kontaktstellen zwischen SRP und dem ribosomalen Tunnel genetisch verändert werden, kommt es zu einer Anhäufung von Membranproteinen, die nicht an ihrem Bestimmungsort eingebaut werden können, und zu Zellteilungsdefekten.
Die Untersuchungen zeigen eine neue Komplexität in der Interaktion zwischen Ribosomen und Proteinsortierungskomplexen: der ribosomale Tunnel, lange Zeit als passive Röhre angesehen, spielt eine entscheidende Rolle bei der Koordination von Prozessen, die schon während der Synthese von Proteinen ablaufen.