Wie Antikörper gegen Malaria zusammen wirken
Kryo-EM zeigt wie Antikörper den Parasiten bekämpfen
Wissenschaftler, die untersuchen, wie das menschliche Immunsystem sich gegen Malaria verteidigt, haben ein seltenes Phänomen entdeckt: Antikörper, die zusammenarbeiten, um sich an eine verwundbare Stelle auf dem Parasiten zu binden.
Die neue Forschung zeigt, dass zusammenwirkende Antikörper dazu führen können, dass ein Protein auf der Zelloberfläche des Parasiten es wie ein breiter Korkenzieher in eine Spiralkonformation sperrt und den Parasiten daran hindert, seinen Lebenszyklus im menschlichen Wirt zu beginnen und sich so vor Infektionen zu schützen.
"Die ersten Bilder waren ziemlich bemerkenswert und gaben uns erste Einblicke, wie das Peptid mit erweiterter Oberfläche erkannt werden konnte", sagt Andrew Ward, PhD, Scripps Research Professor und korrespondierender Autor der Studie. "CryoEM war einzigartig geeignet, diese Struktur zu lösen und öffnet die Tür, um andere wie sie zu lösen. Um einen wirksamen Impfstoff herzustellen, müssen wir die richtige Art der Erkennung dieses typischerweise flexiblen Peptids durch Antikörper verstehen."
Die Studie ist Teil einer internationalen Initiative zur Verbesserung des fortschrittlichsten Malaria-Impfstoffs, genannt RTS,S, der sich in klinischen Studien befindet. Der Impfstoffkandidat ist derzeit etwa 25 bis 50 Prozent wirksam, je nach Impfstoffregime, aber mit Hunderttausenden von Menschen, die immer noch jedes Jahr an Malaria sterben, suchen die Forscher nach Möglichkeiten, Impfstoffe neu zu entwerfen oder zu formulieren.
Um dies zu tun, untersuchen Wissenschaftler auf dem kalifornischen Campus von Scripps Research die Antikörper, die der menschliche Körper produziert, wenn er den RTS,S-Impfstoff erhält. Sie sind besonders an Antikörpern interessiert, die sich frühzeitig an den Malariaparasiten binden und vor Infektionen schützen - und ob diese Antikörper die durch eine natürliche Infektion erzeugten nachahmen.
"Wenn Sie diese erste Phase beim Menschen blockieren können, können Sie den gesamten Lebenszyklus des Parasiten blockieren", sagt Jonathan Torres, wissenschaftlicher Mitarbeiter bei Scripps Research und Mitautor der Studie.
Diese schützenden Antikörper sind dafür bekannt, sich an das Circumsporozoit-Protein der Malaria zu binden, das am häufigsten vorkommende Protein auf der Oberfläche des Parasiten, aber niemand konnte einen klaren Blick darauf werfen, wie sie es machen. Das Verständnis, wie diese Antikörper ihre Arbeit tun, kann helfen, das Design von Malaria-Impfstoffen zu leiten, die die gleiche Antikörperreaktion auslösen können. Diese Technik wird als rationales Impfstoffdesign bezeichnet.
Mit einer bildgebenden Technik namens Kryoelektronenmikroskopie (EM) erhielten die Wissenschaftler die ersten Bilder eines Antikörpers, der an das Zirksporozoitprotein gebunden war. Study Co-First-Autor David Oyen, PhD, ein Forschungsmitarbeiter bei Scripps Research, sagt, er sei überrascht gewesen, was die Kryo-EM-Strukturen enthüllten.
Die Form des Proteins war schon immer schwer abzubilden, da es sich um eine große Region mit geringer Komplexität im Zentrum des Proteins handelt, die aus vielen vier Aminosäure-Wiederholungen besteht, die dem Protein eine schlaffe und flexible Form verleihen. Oyen dachte, Antikörper würden sich an diesen Bereich "wie Perlen an einer Schnur" binden.
Stattdessen zeigten die Kryo-EM-Strukturen den Wiederholungsbereich des in einer Spiralstruktur eingeschlossenen Circumsporozoit-Proteins, wobei 11 Antikörperfragmente (Fab311) aus ihren Bindungsstellen, die aus zwei Wiederholungen bestehen, herausragen und tangential von der länglichen Spirale ausgehen.
Noch überraschender ist, dass die Spiralstabilität durch die Kontakte zwischen den Antikörpern vermittelt wird. "Es ist, als ob sie Arme miteinander verbinden, um einen stärkeren Komplex zu bilden", sagt Oyen. Nach Kenntnis der Wissenschaftler ist es das erste Mal, dass die dreidimensionale Struktur der Wiederholungsregion des Circumsporozoit-Proteins dank der stabilisierenden Antikörperkontakte aufgeklärt wurde. "Nur durch die Mehrfach-Sequenz-Wiederholungen auf diesem Protein sind diese Antikörperkontakte möglich", sagt Oyen.
"Diese Struktur ist sehr aufregend - die vier Aminosäure-Wiederholungssequenzen selbst wurden vor vielen Jahren experimentell gefunden, um eine Beta-Wendung zu bilden, und die mehreren Wiederholungen, die für schraubenförmige Strukturen vorhergesagt wurden, aber diese Struktur unterscheidet sich sehr von denen, da es sich um einen sehr breiten und sehr verlängerten Korkenzieher wie eine große Wendeltreppe handelt", sagt Ian Wilson, DPhil, Hansen Professor für Strukturbiologie bei Scripps Research, Vorsitzender der Abteilung für Integrative Struktur- und Computerbiologie und Co-Autor der Studie.
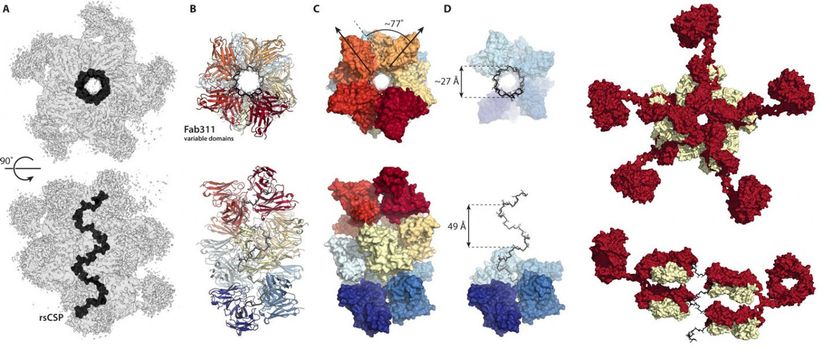
Diese Zahlen aus dem neuen Science Advances-Artikel zeigen, wie sich Antikörper miteinander verbinden, um das Circumsporozoit-Protein von Malaria in eine Spiralkonformation zu bringen.
Wilson/Ward labs, Scripps Research
Der in dieser Studie mit dem Cirsporozoit-Protein gezeigte Antikörper ist nur einer von vielen, die das Team mit Kryo-EM aufnehmen will. Sie hoffen, Strukturen zu vergleichen, um zu sehen, ob Schutzantikörper irgendwelche Merkmale aufweisen. Einige haben vielleicht Antikörperkontakte, andere nicht.
"Wir wollen den Malaria-Impfstoff so gut wie möglich machen", sagt Oyen. "Und wir hoffen, dass wir diese Kryo-EM-Strukturen nutzen können, um neue oder verbesserte Impfstoffkandidaten zu entwickeln."
Originalveröffentlichung
Oyen, David and Torres, Jonathan L. and Cottrell, Christopher A. and Richter King, C. and Wilson, Ian A. and Ward, Andrew B.; "Cryo-EM structure of P. falciparum circumsporozoite protein with a vaccine-elicited antibody is stabilized by somatically mutated inter-Fab contacts"; Science Advances; 2018
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Antikörper
Antikörper sind spezialisierte Moleküle unseres Immunsystems, die gezielt Krankheitserreger oder körperfremde Substanzen erkennen und neutralisieren können. Die Antikörperforschung in Biotech und Pharma hat dieses natürliche Abwehrpotenzial erkannt und arbeitet intensiv daran, es therapeutisch nutzbar zu machen. Von monoklonalen Antikörpern, die gegen Krebs oder Autoimmunerkrankungen eingesetzt werden, bis hin zu Antikörper-Drug-Konjugaten, die Medikamente gezielt zu Krankheitszellen transportieren – die Möglichkeiten sind enorm.
Themenwelt Antikörper
Antikörper sind spezialisierte Moleküle unseres Immunsystems, die gezielt Krankheitserreger oder körperfremde Substanzen erkennen und neutralisieren können. Die Antikörperforschung in Biotech und Pharma hat dieses natürliche Abwehrpotenzial erkannt und arbeitet intensiv daran, es therapeutisch nutzbar zu machen. Von monoklonalen Antikörpern, die gegen Krebs oder Autoimmunerkrankungen eingesetzt werden, bis hin zu Antikörper-Drug-Konjugaten, die Medikamente gezielt zu Krankheitszellen transportieren – die Möglichkeiten sind enorm.